大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
65+岁的老年人发生药物不良反应(adverse drug reactions,ADR)的可能性是年轻人的7倍。随着年龄增长,生理变化会损害身体安全处理药物的能力,从而影响ADR风险。这些变化包括肝血流量减少、止血储备下降和身体成分改变,这些都可能影响药物吸收、分布、代谢和排泄(absorption, distribution, metabolism, and excretion,ADME)过程。然而,这些生理变化发生的时间和程度存在很大的个体差异,药物反应与实际年龄没有很好的相关性。因此,有必要更深入地了解影响ADME过程的与年龄相关的生理变化。
肝脏异生素代谢和转运随着年龄的增长而下降,而完整的异生素代谢与寿命有关。然而很少有研究分析表观遗传衰老对这些过程的全基因组范围内的影响。本文利用简化基因组亚硫酸盐测序(RRBS)绘制了4月龄和24月龄小鼠肝脏的DNA甲基化变化,鉴定出数千个年龄相关差异甲基化位点(age-associated differentially methylated sites,a-DMS),其中许多位点与编码I期和II期药物代谢酶以及ABC和SLC类转运蛋白的基因重叠。尤其Cyp1a2、Cyp2d9和Abcc2三个a-DMS显著基因,分别编码人类药物代谢酶Cyp1a2和CYP2D6以及多药耐药蛋白2(MRP2)转运蛋白的直系同源物。研究表明,随着年龄的增长,Cyp2d9高甲基化与基因表达降低显著相关,而Abcc2表达随着年龄增长没有变化。Cyp1a2随着年龄增长而丢失甲基化,其表达也随着年龄增长而降低。研究还假设了年龄相关的低甲基化,但与年龄相关的肝脏转录机制失调导致基因下调。通过对样品中低甲基化a-DMS进行生物信息学分析,结果表明这些位点在肝细胞核因子4α(HNF4α)结合位点高度富集。HNF4α促进Cyp1a2表达,并随年龄增长而下调,这可以解释Cyp1a2表达的降低。总体而言,本研究支持表观遗传衰老对异生素代谢和转运的广泛影响。未来的工作应该评估肝细胞核受体功能与表观遗传衰老之间的相互作用。这些结果可能对长寿和健康衰老研究具有重要意义。
材料方法:
研究结果:
(1)测序数据统计、质控和整体甲基化水平
本研究通过简化基因组亚硫酸盐测序(RRBS)技术,成功地对小鼠肝脏组织样本进行测序。每个样本平均产生32.9M序列read(范围在25.1M~38.9M),这些reads与mm10基因组的比对情况良好,符合RRBS预期参数(平均比对率71.1%,范围在68.6%~76.9%之间)。非CpG甲基化百分比在0.4%~0.8%之间,表明亚硫酸盐转化效果良好。CpG背景下胞嘧啶的整体甲基化平均水平在4月龄小鼠中为34.3%,而在24月龄小鼠中为33.6%,表明随着年龄增长,基因组整体呈现一定的低甲基化趋势。
(2)年龄相关差异甲基化位点 (a-DMS) 的全基因组分析
通过RRBS DNA甲基化数据分析,研究人员利用主成分分析(PCA)对样本进行了降维处理,并根据相关性和Ward聚类方法对样本进行了聚类分析。图1展示了样本在前两个主成分(PC1和PC2)上的载荷分布,而图2则根据样本间的相关性进行了聚类分析。
在图1中,PC1和PC2能够很好地区分年轻(4月龄)和老年(24月龄)小鼠的样本。表明尽管样本之间存在一定的变异性,但年龄相关的甲基化模式在整体上可以区分。PC1和PC2的主成分分析结果揭示了样本间甲基化水平的显著差异,这些差异可能与年龄相关的生物学过程有关。
图2中的聚类分析进一步证实了这一点,通过Ward聚类方法,样本根据甲基化模式分为两组,分别对应于年轻和老年小鼠。聚类结果表明,尽管存在个体差异,但年龄相关的甲基化变化在小鼠群体中是一致的,并且可以用来区分不同年龄的样本。
这些结果表明,RRBS技术能够有效地捕捉到与年龄相关的DNA甲基化变化,并且这些变化可以通过PCA和聚类分析得到清晰的可视化。
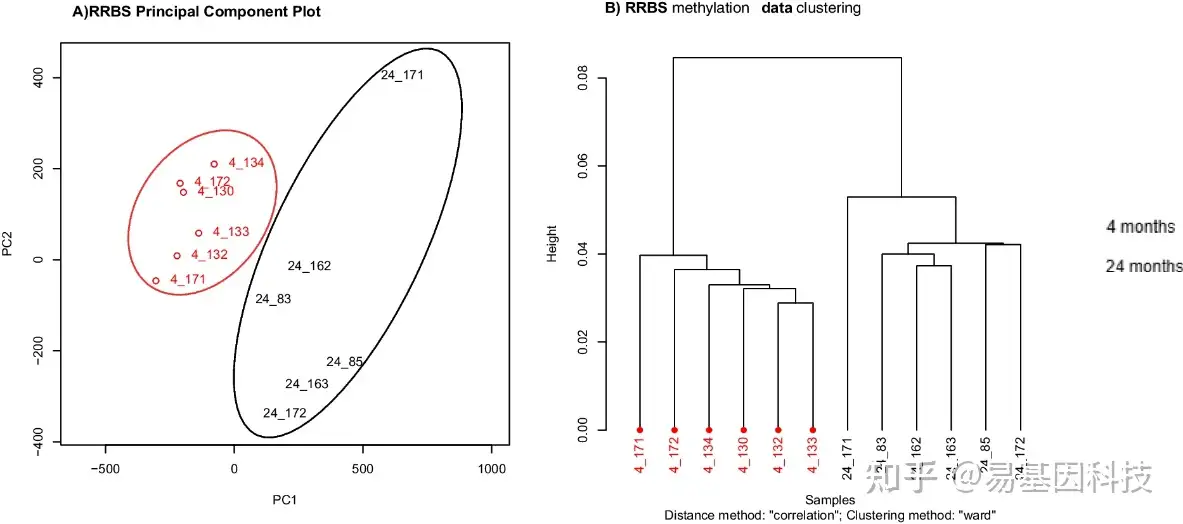
图1:基于相关性和Ward聚类方法(来自MethyKit的分析),在RRBS DNA甲基化数据的前两个主成分上绘制了样本载荷图,并对样本进行了B聚类
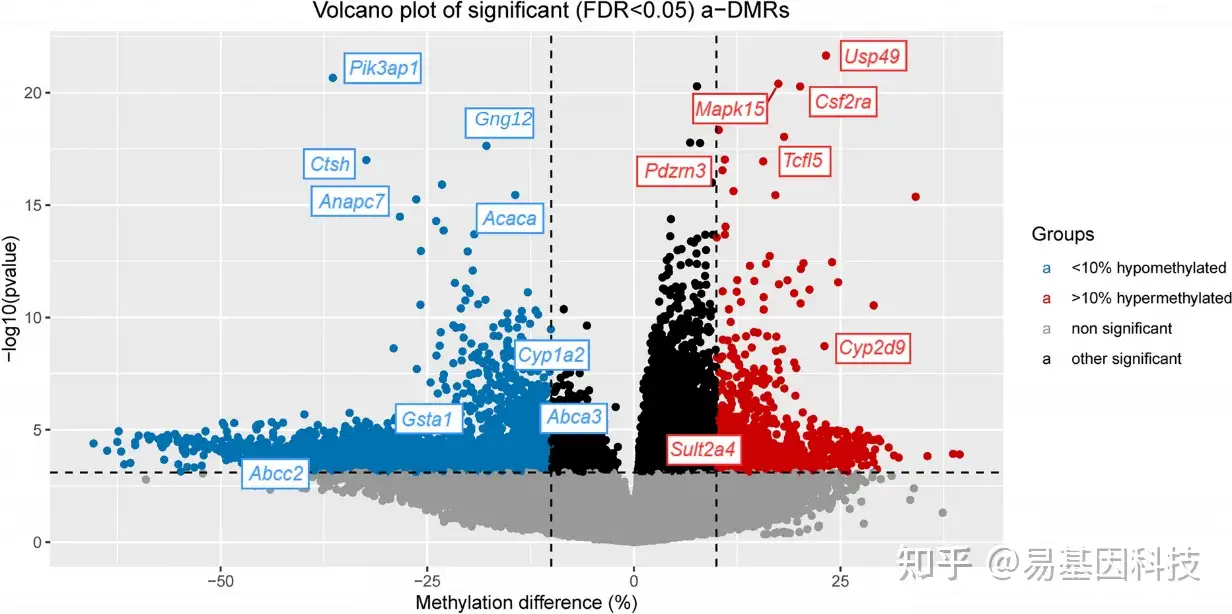
图2:4月龄和24月龄小鼠肝脏中与年龄相关的差异甲基化位点的火山图。y轴是p值的负对数,x轴表示甲基化随年龄的变化。全基因组显著性由小于5%(水平虚线)的错误发现率(FDR)决定。垂直虚线显示随着年龄的增长,>10%高甲基化和 >10%低甲基化。全基因组显著位点显示随着年龄增长,>10%高甲基化为红色,>10%低甲基化为蓝色。显示了与前5个高甲基化和低甲基化位点相关基因,以及顶级异生代谢基因和转运蛋白
(3)与雌性小鼠中的a-DMS整合分析
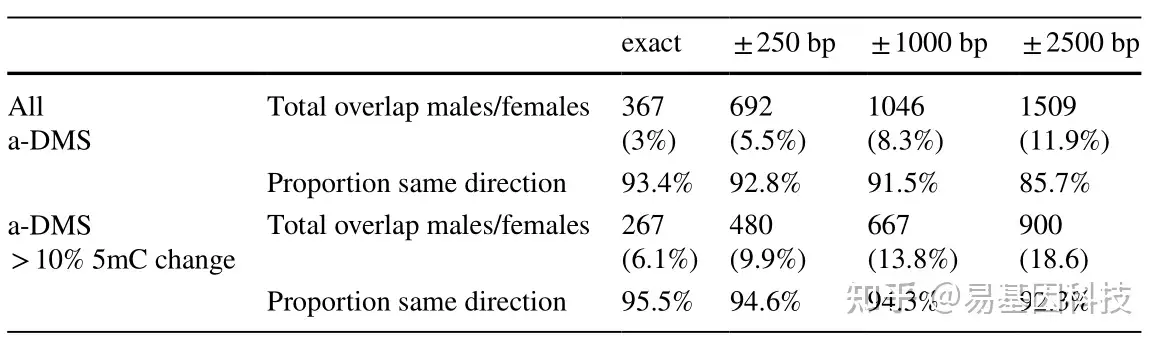
表1:雄性小鼠肝脏中年龄相关差异甲基化位点(a-DMS)与雌性小鼠肝脏中已发表的a-DMS重叠
(4)异生素代谢基因与显著的a-DMS相关
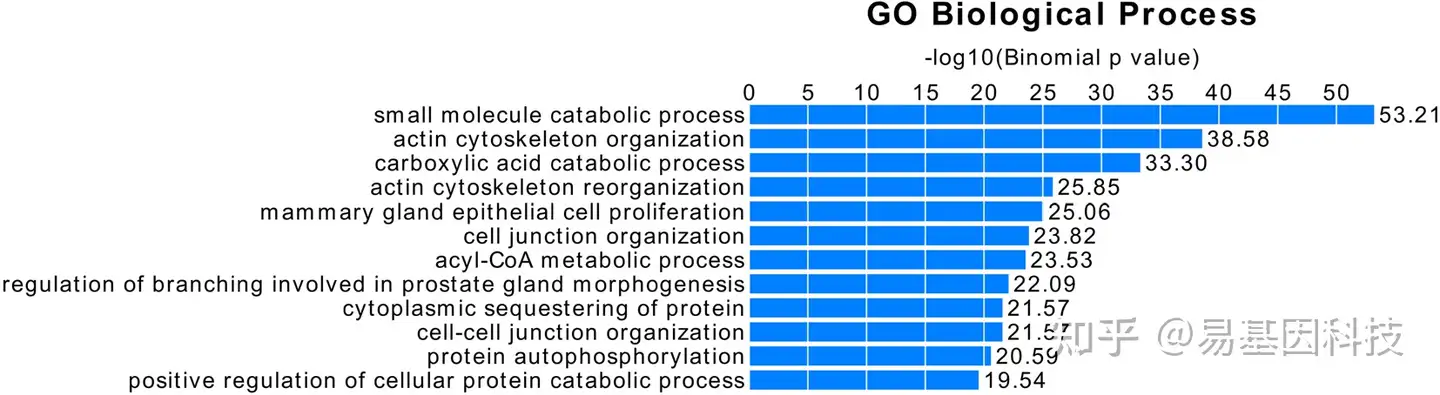
图3:年龄相关差异甲基化位点(a-DMS)的基因本体论(GO)富集分析表明,>10%的高甲基化或低甲基化基因涉及生物学过程。最丰富的生物学过程按照统计显著性递减的顺序显示。使用GREAT(Genomic Regions of Enrichment Annotation Tool)工具进行分析和绘图,揭示了与年龄相关的甲基化变化最显著的基因主要参与的生物学过程。
(5)a-DMS与年龄相关的基因表达变化的整合
从获得RRBS数据的相同生物材料中提取RNA,并使用qPCR检测Cyp1a2、Cyp2d9和Abcc2的表达水平。
研究人员探讨了Cyp2d9、Cyp1a2和Abcc2这三个基因随着年龄增长在DNA甲基化和表达水平上的变化。通过RRBS数据分析,研究显示Cyp2d9基因随着年龄的增长出现了甲基化水平增加(hypermethylation),而Cyp1a2和Abcc2则表现出甲基化水平降低(hypomethylation)。
在基因表达水平方面,与4月龄小鼠相比,Cyp2d9和Cyp1a2这两个基因在24月龄小鼠中表达水平降低,而Abcc2基因的表达水平在年龄增长过程中没有显著差异。
此外,研究还分析了甲基化水平与基因表达之间的关系。Cyp2d9甲基化水平的增加与基因表达水平的降低之间存在显著的负相关关系。表明随着年龄的增长,Cyp2d9甲基化水平增加可能导致其表达水平的降低。然而,对于Cyp1a2和Abcc2,甲基化水平的变化与基因表达水平之间没有显著的关联。这可能意味着除了DNA甲基化之外,还有其他因素影响这些基因的表达。
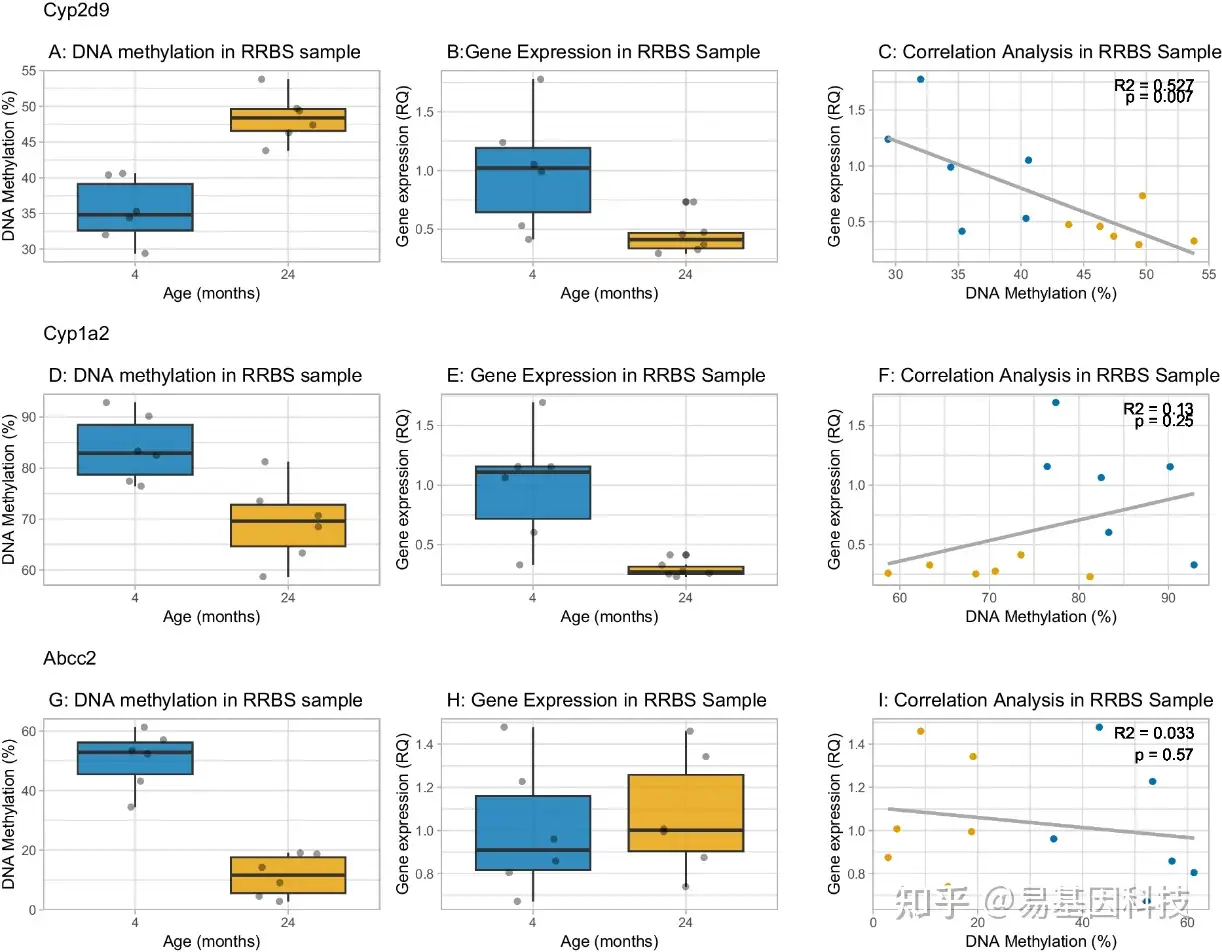
图4:Cyp2d9、Cyp1a2和Abcc2的DNA甲基化和表达随年龄而变化。
A、D、G:三个位点DNA甲基化随年龄变化最显著,Cyp2d9随着年龄增长而显示高甲基化,而Cyp1a2和Abcc2随着年龄增长而显示低甲基化(来自RRBS的数据)。
B、E、H:RNA随年龄变化的相对定量,其中4月龄小鼠样本设置为平均值=1.0。随着年龄增长,两种Cyp基因的基因表达均较低,而Abcc2表达随年龄的增长无显著差异。
C、F、I:甲基化水平与基因表达之间的相关性。Cyp2d9的两个变量之间存在显著的负相关关系,而Cyp1a2和Abcc2的DNA甲基化变化与年龄和表达之间没有显著关联。(n=每个年龄组6只小鼠)
(6)结果的验证和重复
通过使用高分辨率熔解(HRM)技术分析亚硫酸盐转化后的DNA,研究人员对Cyp2d9和Cyp1a2基因随年龄增长在DNA甲基化和表达变化的实验进行重复。这些结果在一个独立的雄性小鼠样本集中得到了验证,每个年龄组(4月龄和24月龄)都有6只小鼠。
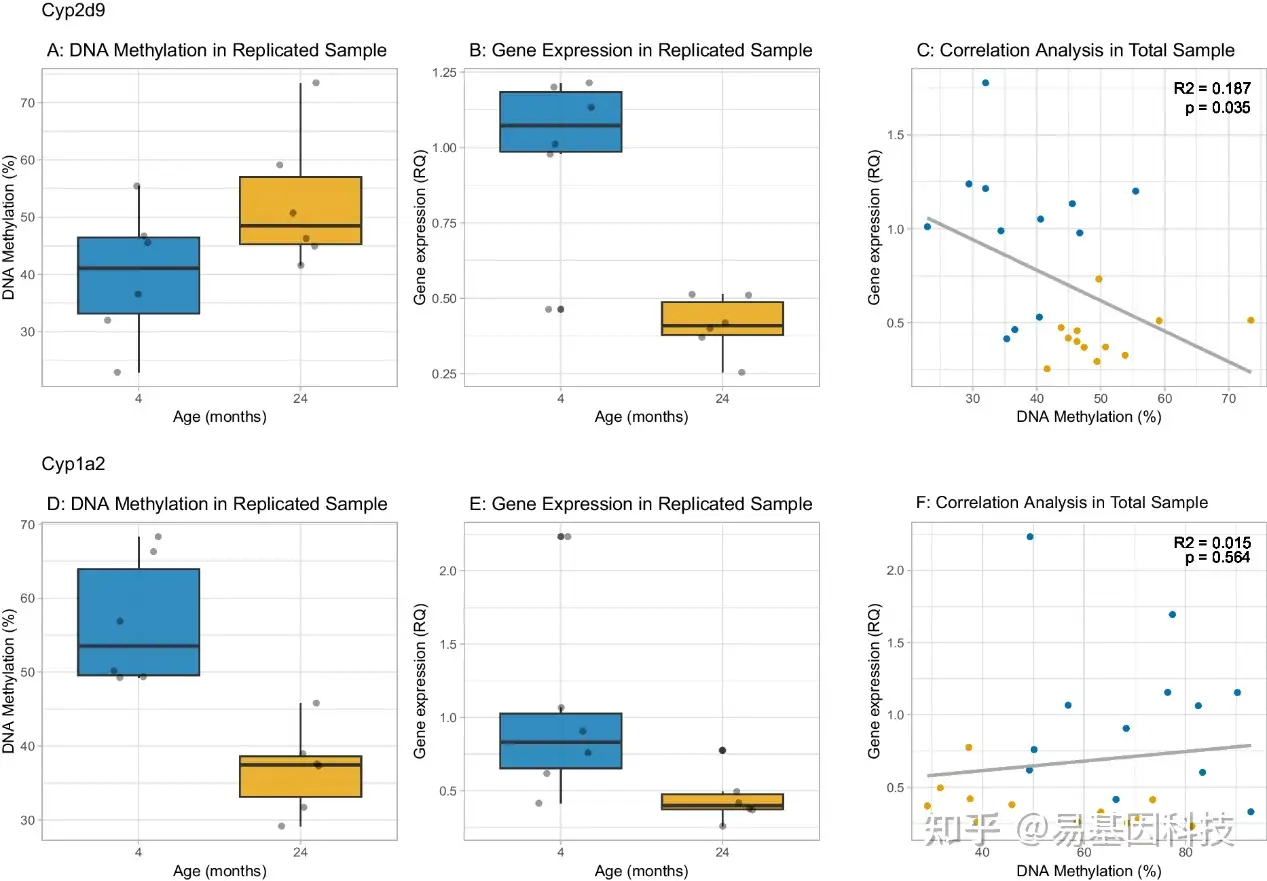
图5:Cyp2d9和Cyp1a2的DNA甲基化和表达年龄相关变化的重复。
A、D:显示了在一个独立的雄性受试者样本(每个年龄组n=6),使用靶向技术,对亚硫酸氢盐转化的DNA进行高分辨率熔解(HRM)分析。展示了在Cyp2d9和Cyp1a2基因的最显著差异甲基化位点(a-DMS)上,随着年龄的增长,DNA甲基化的变化情况。对于Cyp2d9,结果显示随着年龄的增长,DNA甲基化水平增加,而对于Cyp1a2,甲基化水平则呈现降低趋势。
B、E:分别显示了重复样品中Cyp2d9和Cyp1a2的基因表达随年龄的变化。Cyp2d9随着年龄的增长,基因表达水平降低,这与甲基化水平增加有关。
C:Cyp2d9 DNA甲基化与表达呈显著负相关,DNA甲基化增加导致表达减少。(每个年龄组n=12)。Cyp2d9的DNA甲基化和表达之间存在显著的负相关关系。这意味着随着甲基化水平的增加,Cyp2d9的表达水平降低。
F:在合并的发现和重复样本中,Cyp1a2甲基化与表达水平之间没有显著的相关性,表明Cyp1a2基因的表达降低可能受到除DNA甲基化之外的其他因素的影响。
(7)DNA甲基化衰老对Cyp1a2表达的远端影响
研究人员探讨了随着年龄增长,DNA甲基化衰老对Cyp1a2基因表达的远端效应。研究人员提出了假设,即远端(长远)高甲基化差异甲基化位点(a-DMS)可能会影响Cyp1a2表达降低。为了验证这一假设,研究人员分析了整个基因组中所有a-DMS的甲基化水平与Cyp1a2表达之间的关联。
通过多重假设检验校正(False Discovery Rate, FDR < 0.05),研究人员发现没有任何a-DMS与Cyp1a2表达显示出足够强的关联性。这意味着在他们的RRBS数据捕获的任何位点上,远端a-DMS不太可能是导致Cyp1a2基因表达随年龄增长而降低的主要原因。
(8)低甲基化a-DMS的位点重叠分析
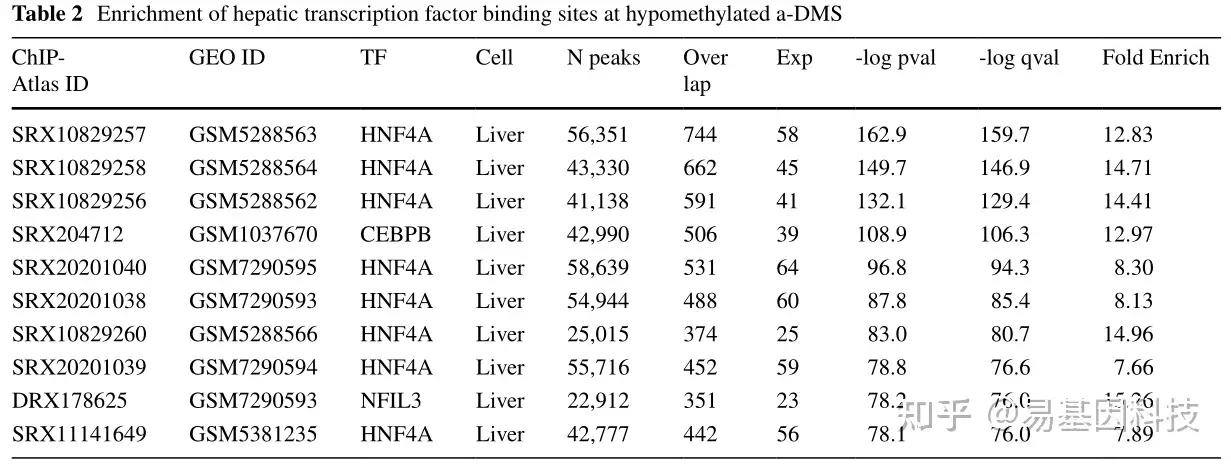
表2:低甲基化a-DMS肝脏转录因子结合位点的富集
| 易基因表观遗传时钟检测 ● 衰老与再生医学 ● 甲基化年龄预测>>> 基于亚硫酸盐测序技术>>> 基于甲基化芯片技术人类 大小鼠 …… |
|---|
关于易基因简化基因组甲基化测序(RRBS)研究解决方案
简化甲基化测序(Reduced Representation Bisulfite Sequencing,RRBS)是利用限制性内切酶对基因组进行酶切,富集启动子及CpG岛等重要的表观调控区域并进行重亚硫酸盐测序。该技术显著提高了高CpG区域的测序深度,在CpG岛、启动子区域和增强子元件区域可以获得高精度的分辨率,是一种准确、高效、经济的DNA甲基化研究方法,在大规模临床样本的研究中具有广泛的应用前景。
为适应科研技术的需要,易基因进一步开发了可在更大区域内捕获CpG位点的双酶切RRBS(dRRBS),可研究更广泛区域的甲基化,包括CGI shore等区域。
为助力适用低起始量DNA样本(5ng)量多维度甲基化分析,易基因开发了富集覆盖CpG岛、启动子、增强子、CTCF结合位点的甲基化靶向基因组测序方法:extended-representation bisulfite sequencing(XRBS),实现了高灵敏度和微量样本复用检测,使其具有高度可扩展性,并适用于有限的样本和单个细胞基因组CG位点覆盖高达15M以上。
技术优势:
- 起始量:100ng gDNA;
- 单碱基分辨率;
- 多样本的覆盖区域重复性可达到85%-95%、测序区域针对高CpG调控区域,数据利用率更高;
- 针对性强,成本较低;
- 基因组CG位点覆盖高达10-15M,显著优于850K芯片。
应用方向:
RRBS/dRRBS/XRBS广泛应用于动物,要求全基因组扫描(覆盖关键调控位点)的:
- 队列研究、疾病分子分型、临床样本的甲基化 Biomarker 筛选
- 复杂疾病及肿瘤发病机制等甲基化研究
- 模式动物发育和疾病甲基化研究
易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化)和表观转录组学(m6A、m5C、m1A、m7G)、染色质结构与功能组学技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900.

参考文献:
Abudahab S, Kronfol MM, Dozmorov MG, Campbell T, Jahr FM, Nguyen J, AlAzzeh O, Al Saeedy DY, Victor A, Lee S, Malay S, Lapato DM, Halquist MS, McRae M, Deshpande LS, Slattum PW, Price ET, McClay JL. Genome-wide analysis of hepatic DNA methylation reveals impact of epigenetic aging on xenobiotic metabolism and transport genes in an aged mouse model. Geroscience. 2024 Apr 1.
相关阅读:
基于亚硫酸盐测序的交集时钟揭示人类胚胎发生过程中年轻化事件 | 甲基化年龄
“衰老标志物”重磅综述:细胞衰老、器官衰老、衰老时钟及其应用
标签:Cyp1a2,DNA,对异,基因,甲基化,表达,年龄 From: https://www.cnblogs.com/E-GENE/p/18124048