大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
出生体重是一个复杂的多因素性状,与后期生活中的健康状况和疾病风险有关。胎盘对胎儿的正常生长至关重要,并负责促进母体和发育中胎儿之间的气体、营养和废物交换。胎盘DNA甲基化变化如何影响胎儿出生体重尚未完全阐明。研究证实,DNA甲基化调节滋养层侵袭和胎盘发育,但DNA甲基化如何在塑造胎盘形态结构和调控出生体重方面发挥作用仍很大程度上未知。
华南农业大学顾婷副教授团队先前的研究揭示了受精后21天、28天和35天猪胎胎盘的DNA甲基化谱。本研究首次整合了RNA测序(RNA-seq)和全基因组亚硫酸盐测序(WGBS),为同窝中不同出生体重仔猪胎盘提供了基因表达和DNA甲基化模式的全面分析。研究强调了DNA甲基化在塑造不同胎盘的转录程序中的关键作用,可能为DNA甲基化参与调控胎盘发育和仔猪出生体重提供新的见解。相关研究成果于2024年7月13日以“Comprehensive Analysis of Placental DNA Methylation Changes and Fetal Birth Weight in Pigs”(猪胎盘DNA甲基化变化与胎儿出生体重的综合分析)为题发表在《International Journal of Molecular Sciences》(IF 5.6)期刊上。

研究对三胎杜洛克雌猪的胎盘母体取高出生体重(highest birth weight,HBW)和低出生体重(lowest birth weight,LBW)仔猪胎盘样本进行WGBS和RNA-seq测序分析,揭示了同窝出生体重最重和最轻仔猪胎盘的整体DNA甲基化和基因表达变化图谱。转录组分析鉴定出1682个差异表达基因,揭示了不同胎盘中的关键转录特性。研究还鉴定出可能驱动胎盘DNA甲基化模式差异的关键转录因子,启动子中DNA甲基化水平降低与与血管生成、细胞外基质重塑和跨膜转运相关的基因转录激活相关。本研究结果揭示DNA甲基化在基因转录活性中的调控作用,从而导致胎盘形态结构和仔猪出生体重的差异。这些结果可能为阐明胎盘发育和胎儿生长的潜在调控机制提供新的线索。
研究方法
- WGBS和RNA-seq绘制同窝中最重和最轻出生体重仔猪胎盘的DNA甲基化和基因表达谱。
- 比较HBW或LBW胎盘的形态学特征和基因表达模式。
- GO富集分析、KEGG通路分析、基因集富集分析(GSEA)。
研究结果
(1)HBW和LBW胎盘形态学特征和基因表达变化
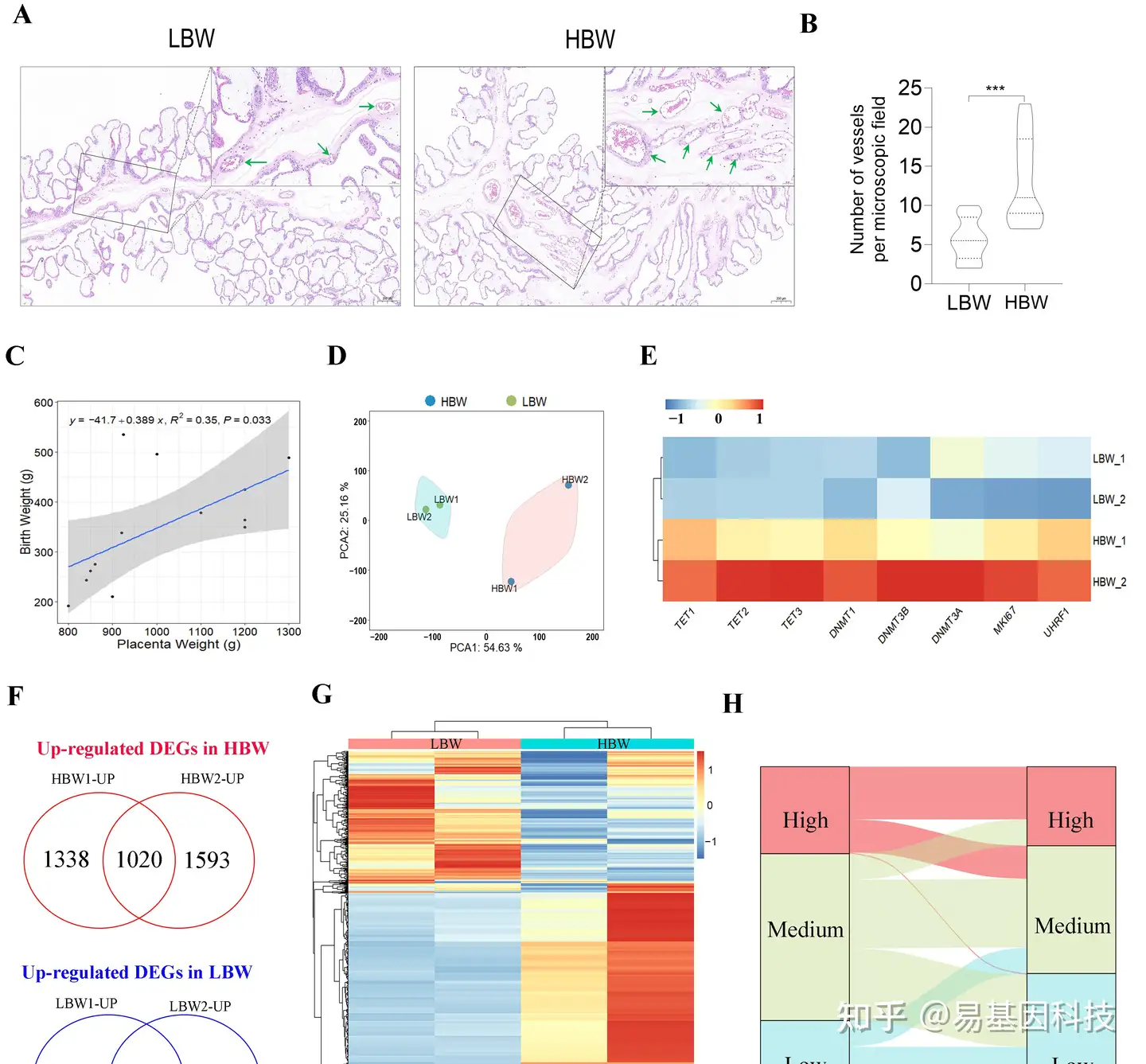
图1:高出生体重(HBW)和低出生体重(LBW)胎盘之间的形态学和基因表达变化
A. H-E染色观察HBW和LBW胎盘的形态变化。
B. 直方图显示每组胎盘的血管密度。
C. 散点图显示出生体重与胎盘重量之间的正相关(样本数n=13)。
D. 每份样本基因表达数据的主成分分析(PCA)结果。
E. 基于RNA-seq的DNMTs(DNA甲基转移酶)和dMTases(DNA去甲基化酶)表达水平热图。
F. LBW组与HBW组之间上调或下调差异表达基因(DEGs)重叠。
G. 差异表达基因的分层聚类热图。
H. 差异表达基因的Alluvial(沉积物)图。
(2)差异表达基因的功能富集分析
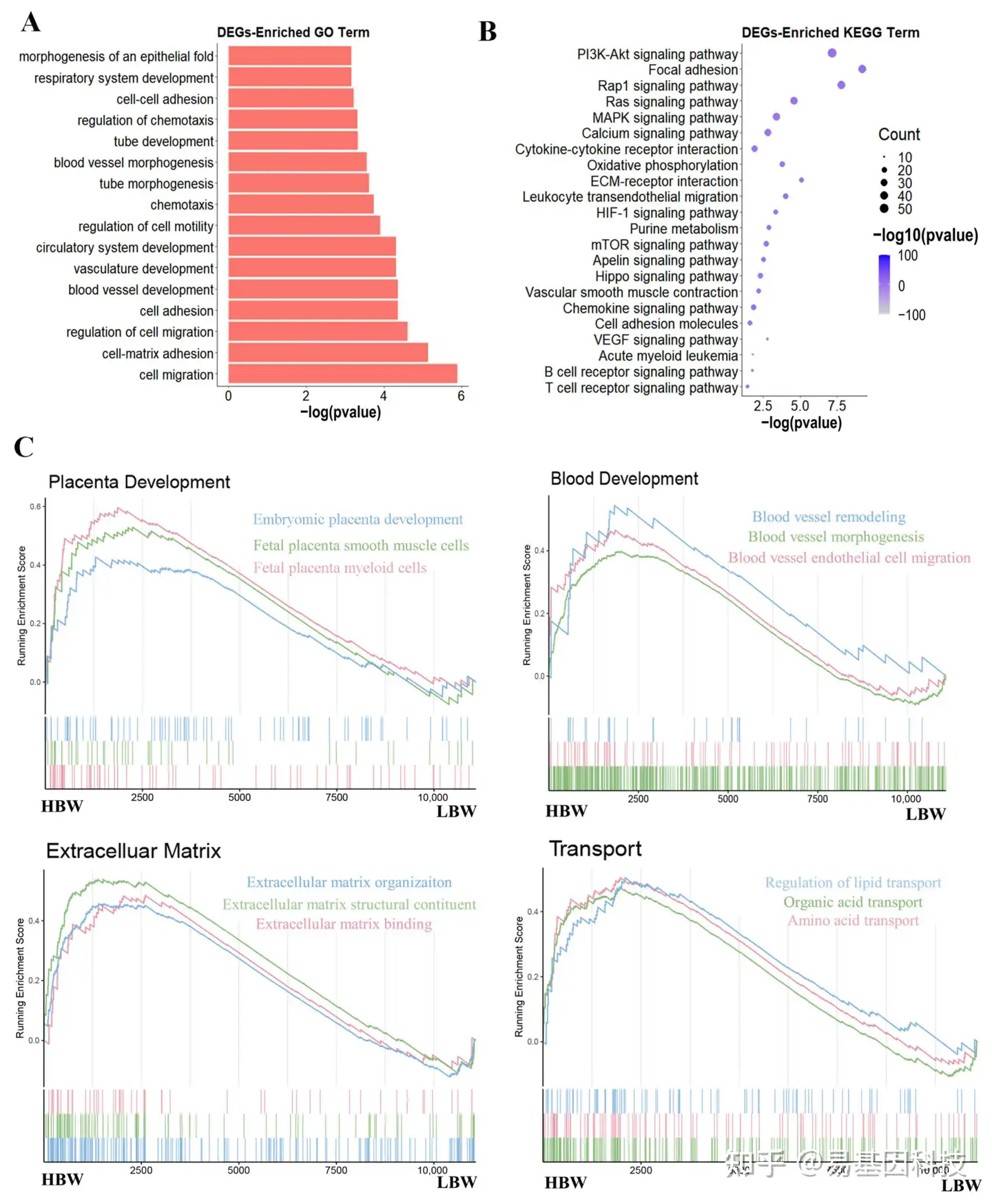
图2:差异表达基因的功能富集分析。
A. DEGs的GO富集分析。
B. DEGs的KEGG通路分析。
C. 参与各种过程的基因的GSEA图。
(3)HBW和LBW胎盘中DNA甲基化组特征
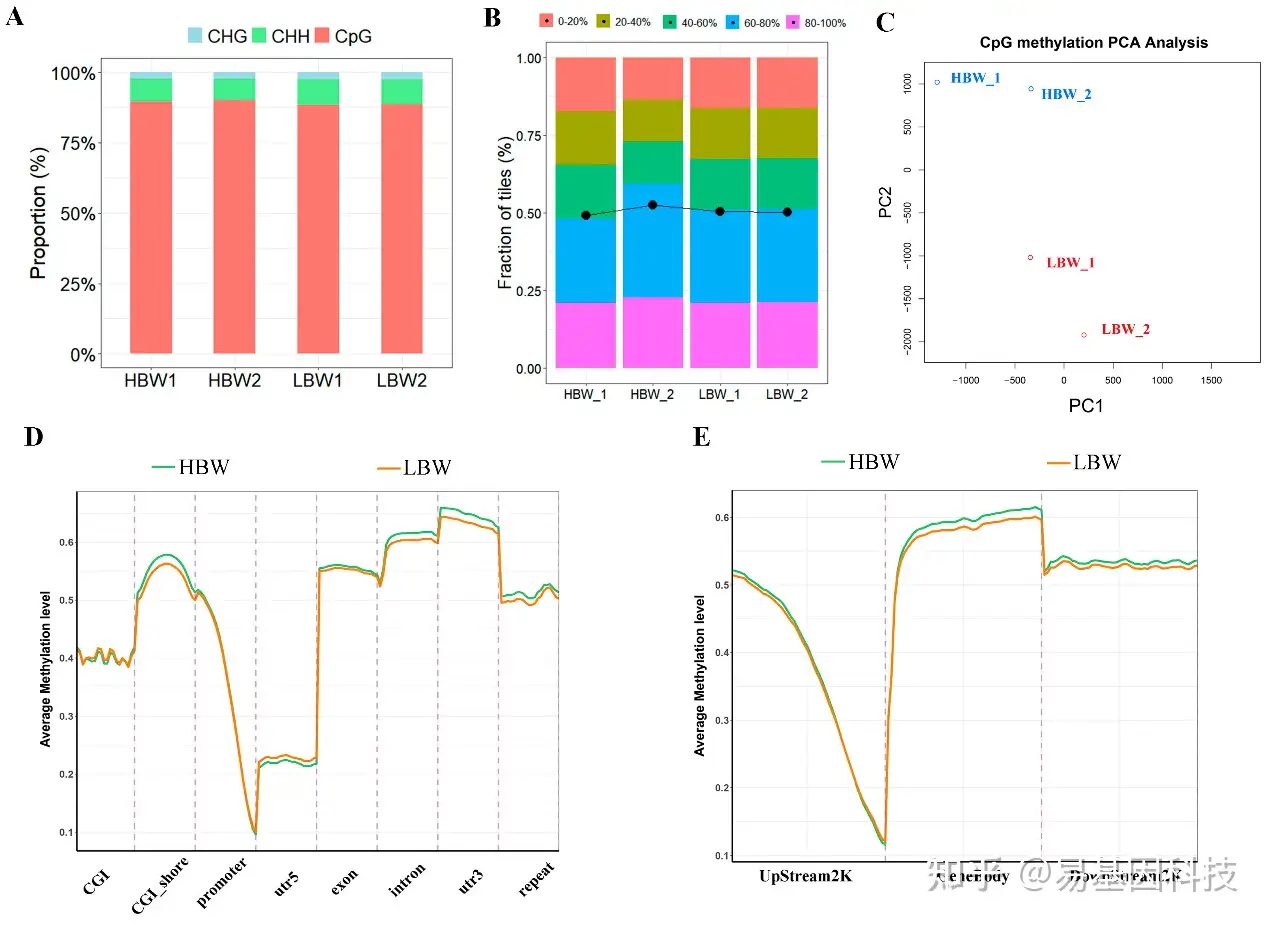
图3:HBW和LBW胎盘中DNA甲基化组特征。
A. CHG、CHH和CpG位点中甲基化胞嘧啶位点比例(其中H=A、C或T)。
B. 不同胎盘中具有不同甲基化水平的CpG位点总量比例。括号中的比率(甲基化CpG/所有CpG)从左到右分别是0.492708、0.525829、0.505327和0.502685,这些数值反映不同样本中CpG位点甲基化水平。
C. 每个样本CpG甲基化数据的主成分分析(PCA)结果。
D-E. HBW和LBW胎盘不同基因组特征(如启动子、基因体、CpG岛等)中CpG的平均甲基化水平。
(4)HBW和LBW胎盘中DNA甲基化谱动态变化
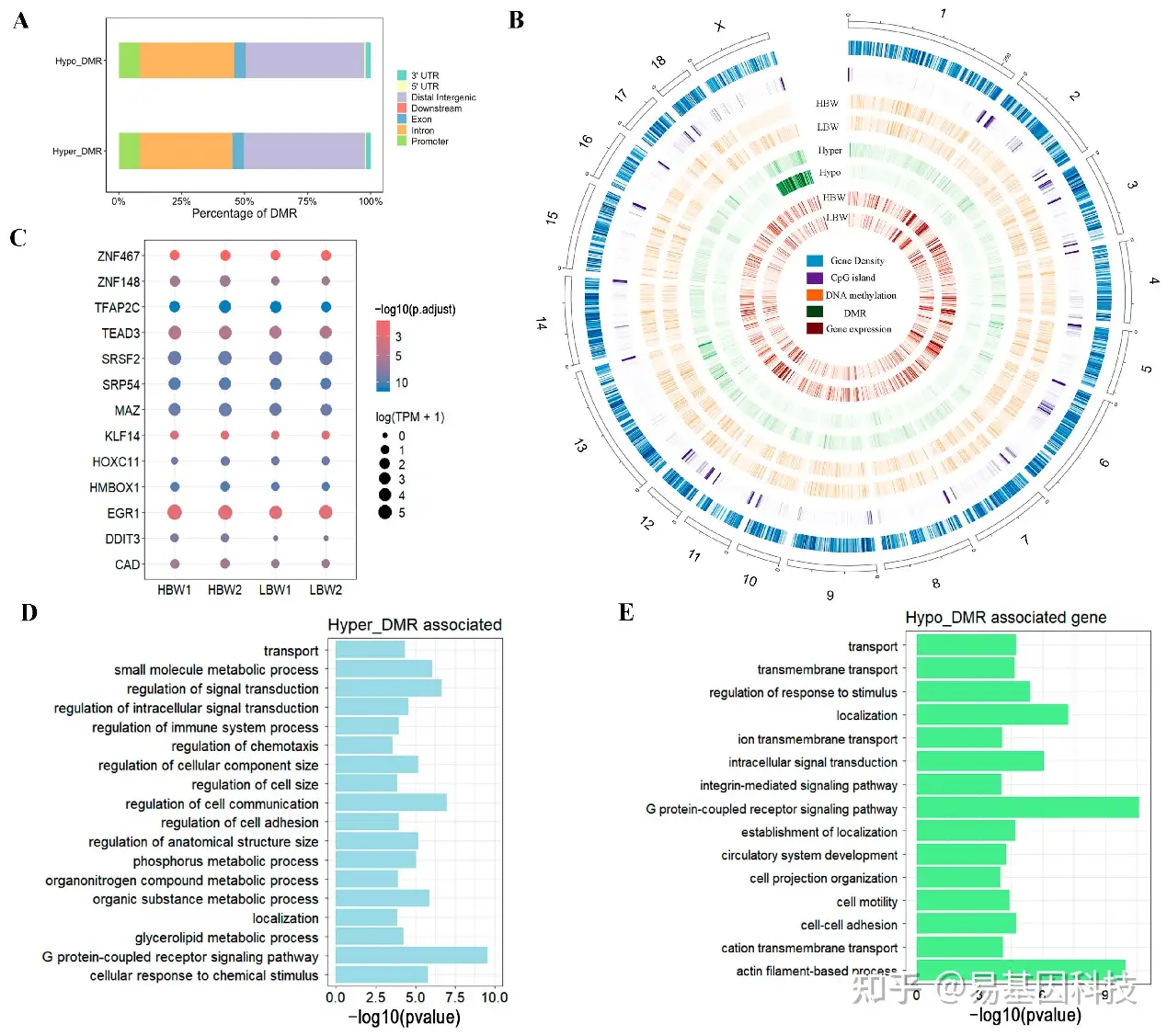
图4: HBW和LBW胎盘中DNA甲基化谱动态变化:
A. 不同基因组特征上的不同甲基化区域(DMRs)所占比例。
B. Circos图展示了所有染色体上甲基化分布的情况。从外圈到内圈依次是:基因密度、CpG岛、HBW胎盘平均甲基化水平、LBW胎盘平均甲基化水平、高甲基化DMR(hyper-methylated DMRs)、低甲基化DMRs(hypo-methylated DMRs)、HBW胎盘的平均甲基化水平、LBW胎盘的平均甲基化水平。
C. 对启动子区域DMRs进行转录因子(TF)富集分析。
D-E. 展示启动子区域高甲基化和低甲基化DMRs的GO分析结果。
(5)HBW和LBW胎盘中DNA甲基化与基因表达的相关性
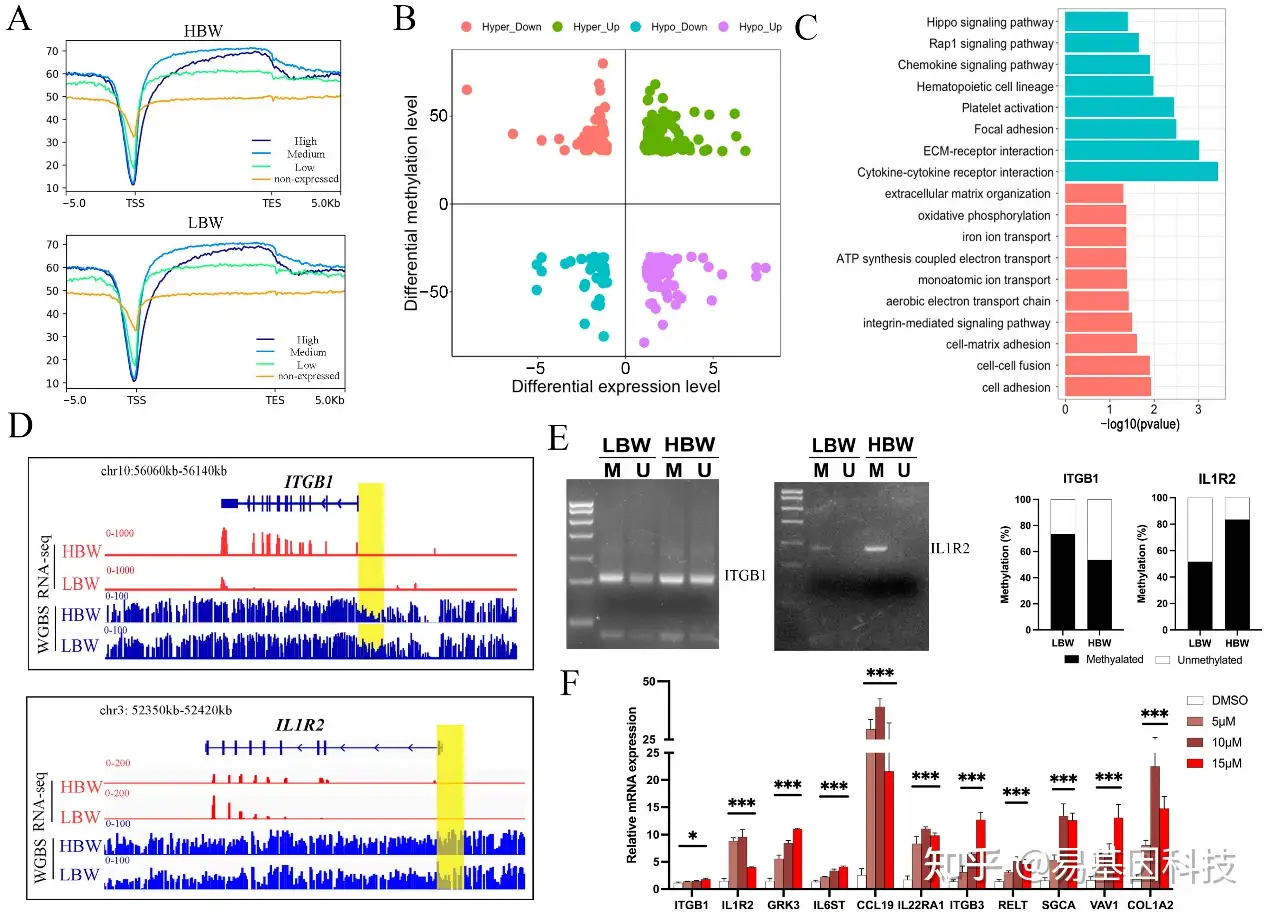
图5:胎盘DNA甲基化组和转录组的综合分析
A. 富集图显示不同表达水平(高、中、低和不表达)Genebody区周围的DNA甲基化水平。
B. 四象限图显示在HBW和LBW胎盘中甲基化水平和表达水平均显著变化的基因。
C. 对启动子阴性基因(PNGs)进行GO和KEGG富集分析。蓝色:KEGG通路;红色:GO生物过程。
D. IGV可视化工具展示HBW和LBW胎盘中ITGB1和IL1R2基因的WGBS和RNA-seq轨迹。启动子DMRs用黄色表示。
E. 对HBW和LBW胎盘中ITGB1和IL1R2基因的启动子进行亚硫酸盐特异性PCR(MSP)分析。M:甲基化等位基因;U:未甲基化等位基因。
F. 在PTr2细胞中,5-Aza诱导的去甲基化后选定PNGs的mRNA表达变化。
易小结
本研究首次整合RNA-seq和WGBS技术,对同窝不同出生体重仔猪胎盘的基因表达和DNA甲基化模式进行全面分析。研究结果揭示了DNA甲基化通过调控基因表达来调节胎盘发育,可能最终导致仔猪出生体重差异。表明了DNA甲基化在胎盘发育和胎儿生长中的调控作用,为后续研究提供了新的视角和潜在的生物标记。这项研究为理解出生体重的调控机制提供了重要的生物学见解,可能有助于减少后期生活中的疾病风险,并改进动物生产。
关于易基因全基因组重亚硫酸盐测序(WGBS)
全基因组重亚硫酸盐甲基化测序(WGBS)可以在全基因组范围内精确的检测所有单个胞嘧啶碱基(C碱基)的甲基化水平,是DNA甲基化研究的金标准。WGBS能为基因组DNA甲基化时空特异性修饰的研究提供重要技术支持,能广泛应用在个体发育、衰老和疾病等生命过程的机制研究中,也是各物种甲基化图谱研究的首选方法。
易基因全基因组甲基化测序技术通过T4-DNA连接酶,在超声波打断基因组DNA片段的两端连接接头序列,连接产物通过重亚硫酸盐处理将未甲基化修饰的胞嘧啶C转变为尿嘧啶U,进而通过接头序列介导的 PCR 技术将尿嘧啶U转变为胸腺嘧啶T。
应用方向:
WGBS广泛用于各种物种,要求全基因组扫描(不错过关键位点)
- 全基因组甲基化图谱课题
- 标志物筛选课题
- 小规模研究课题
技术优势:
- 应用范围广:适用于所有参考基因组已知物种的甲基化研究;
- 全基因组覆盖:最大限度地获取完整的全基因组甲基化信息,精确绘制甲基化图谱;
- 单碱基分辨率:可精确分析每一个C碱基的甲基化状态。

易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化)和表观转录组学(m6A、m5C、m1A、m7G)、染色质结构与功能组学技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900.

参考文献:
Tan B, Xiao L, Wang Y, Zhou C, Huang H, Li Z, Hong L, Cai G, Wu Z, Gu T. Comprehensive Analysis of Placental DNA Methylation Changes and Fetal Birth Weight in Pigs. Int J Mol Sci. 2024 Jul 13;25(14) pii: ijms25147702. doi: 10.3390/ijms25147702. PubMed PMID: 39062945.
相关阅读:
1. Cell|易基因微量DNA甲基化测序助力中国科学家成功构建胚胎干细胞嵌合体猴,登上《细胞》封面
2. Nature | 易基因DNA甲基化测序助力人多能干细胞向胚胎全能8细胞的人工诱导3. WGBS+RNA-seq揭示黄瓜作物的“源-库”关系受DNA甲基化调控
4. WGBS等揭示SOX30甲基化在非梗阻性无精症中的表观遗传调控机制
5. WGBS+RNA-seq揭示PM2.5引起男性生殖障碍的DNA甲基化调控机制
6. WGBS+RNA-seq揭示松材线虫JIII阶段形成过程中的DNA甲基化差异
7. 微量DNA甲基化分析揭示MeCP2在卵子发生和卵巢衰老中的表观遗传调控
8. 单细胞DNA甲基化与转录组分析揭示猪生发泡卵母细胞成熟的关键调控机制
9. 植入前胚胎的全基因组DNA甲基化和转录组分析揭示水牛胚胎基因组激活进展
10. 微量DNA甲基化分析揭示MeCP2在卵子发生和卵巢衰老中的表观遗传调控
11. 易基因2023年度DNA甲基化研究项目文章精选12. 易基因2022年度DNA甲基化研究高分项目文章精选
13. 微量样本及单细胞DNA甲基化研究如何发高分SCI文章(特别适用珍稀样本)
标签:DNA,LBW,基因,速递,胎盘,甲基化,HBW From: https://www.cnblogs.com/E-GENE/p/18344816