大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
环境因素如饮食和生活方式,可以影响哺乳期母体及其子代的健康,但其跨代传递及潜在机制尚不清楚。研究表明,父母的饮食模式和生活方式可以影响子代的健康;同时大量研究表明孕产妇营养状况与子代健康之间存在相关性。母乳中的生物活性物质和营养物质支持婴儿的免疫发育和身体生长。而母体蛋白质营养不良、西方饮食、高纤维未加工饮食、高糖饮食和低纤维饮食等已被证明可以影响子代表型,这与健康和疾病发育起源(DOHaD)的假设一致。尽管亲本饮食对子代的影响已被广泛研究,但其潜在机制和跨代传递知之甚少。
DNA甲基化在生殖细胞特异性、成熟和早期发育中起着至关重要的作用。在雌性生殖细胞中,DNA甲基化发生在出生后,并持续到青春期,且DNA甲基化可以在哺乳动物中跨代传递。DNA甲基化易受环境因素影响,父体低蛋白饮食可以诱导精子DNA低甲基化,而子宫内营养不良则扰乱卵母细胞和精子甲基化。母体高脂饮食影响卵母细胞DNA甲基化,产前饥荒也会影响与生长和代谢疾病相关基因的DNA甲基化状态。但目前尚不清楚哺乳期母体饮食如何影响子代健康。
近日,中国科学院动物研究所顾林舰博士为第一作者、广东省第二人民医院孙青原教授为通讯作者在《Journal of Genetics and Genomics》(JGG)期刊发表题为“The transgenerational effects of maternal low-protein diet during lactation on offspring“的研究成果,该研究使用母体哺乳期低蛋白饮食(LPD)的小鼠模型,研究LPD饮食如何通过卵母细胞的DNA甲基化变化及其基因调控等表观遗传影响子代的生存、生长、繁殖能力以及代谢健康,并探讨其跨代传递的潜在机制。易基因为本研究提供scRRBS分析技术服务。

标题:The transgenerational effects of maternal low-protein diet during lactation on offspring(哺乳期母体低蛋白饮食对子代的影响)
期刊:《Journal of Genetics and Genomics》(JGG)
影响因子: IF 6.6
技术平台:scRRBS、scRNA-seq(Smart-Seq2)、16s等
本研究利用母体哺乳期低蛋白饮食(LPD)小鼠模型,展示了母体LPD在哺乳期会导致存活率下降和生长迟缓,显著减少排卵和窝仔大小,并改变雌性LPD子代的新陈代谢、肠道微生物组和卵母细胞转录组。LPD-F1中期II(MII)卵母细胞转录组测序分析结果表明,差异表达基因在女性妊娠和多个代谢过程中富集。母体LPD导致早期生长迟缓并损害代谢健康,这些影响可以传递超过两代。研究还利用采用单细胞简化基因组亚硫酸盐测序 (scRRBS)来分析LPD和LPD-F1卵母细胞甲基化模式变化部分可以传递给F2卵母细胞,阐明哺乳期间母体营养如何影响子代的生殖细胞 DNA 甲基化,从而探索跨代传递机制。总之,本研究结果揭示了LPD在哺乳期通过卵母细胞表观遗传变化跨代传递影响子代健康。
研究方法:
本研究使用母体哺乳期低蛋白饮食(LPD)小鼠模型,研究哺乳期母体LPD对子代发育和代谢的影响。研究中,LPD-F0雌鼠在哺乳期间体重低于对照饮食(CD)-F0。通过检测F1和F2代小鼠的体重变化、繁殖能力、葡萄糖耐量和胰岛素耐量,以及对F1代成年雌性卵母细胞进行单细胞RNA测序(scRNA-seq)和单细胞简化基因组重亚硫酸盐测序(scRRBS)分析,研究母体LPD对卵母细胞转录组和甲基化模式的影响。
研究结果:
研究发现,母体LPD在哺乳期会导致F1代和F2代子代生长迟缓、存活率降低和繁殖能力下降。F1代雌性子代的窝仔数减少,自然排卵数量减少。F2代虽然出生体重正常,但在早期体重增长缓慢。此外,母体LPD还导致子代代谢健康受损,这种影响在两代中都有所体现。F1代卵母细胞的甲基化模式发生显著变化,这些变化部分可以传递给F2代卵母细胞。研究表明,哺乳期母体LPD通过卵母细胞的表观遗传变化,对子代健康产生跨代传递。这些发现揭示了母体饮食与子代健康之间的潜在分子联系,并为进一步研究提供了新的视角。
(1)哺乳期的母体低蛋白饮食影响子代健康。
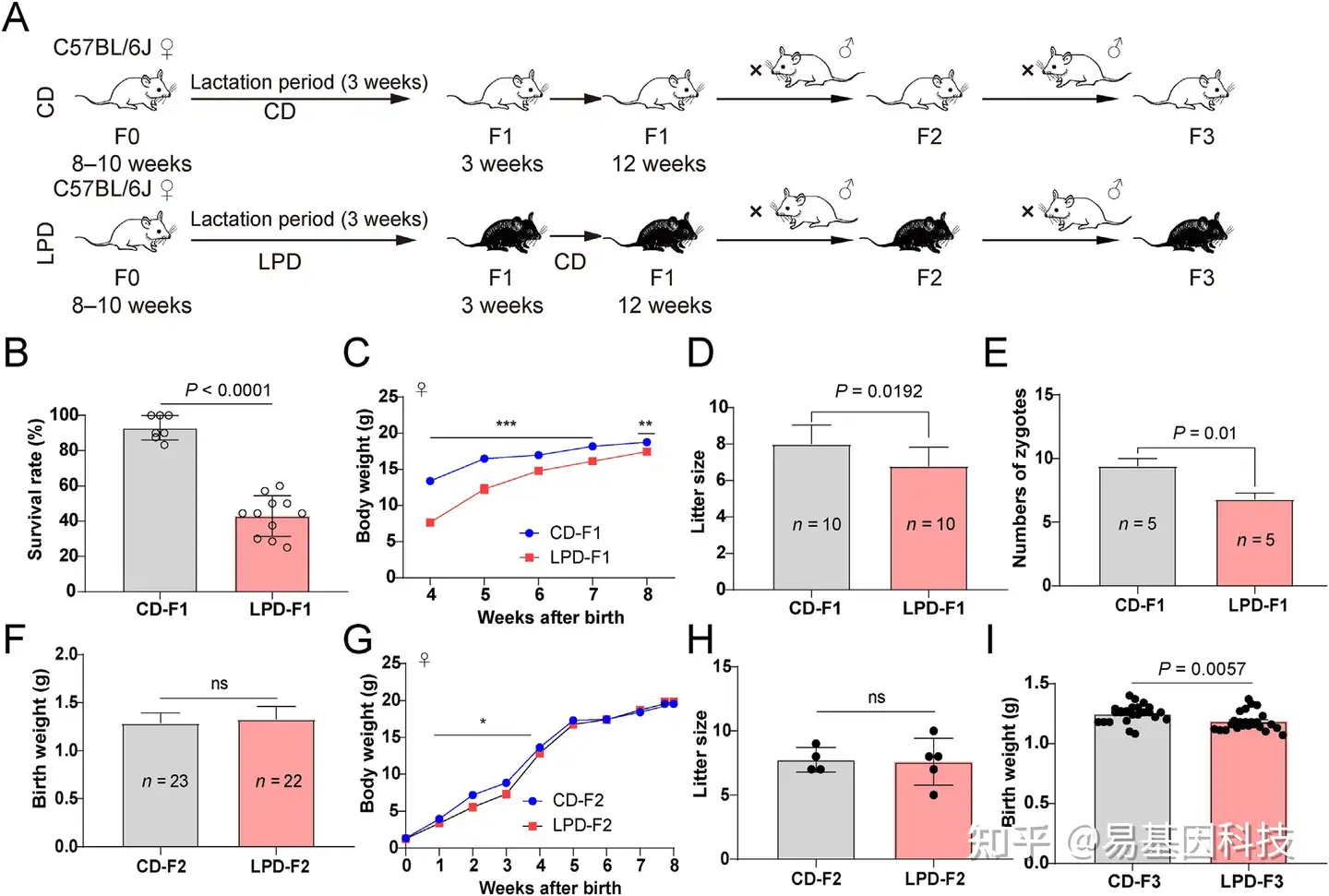
图1:哺乳期母体低蛋白饮食(LPD)影响子代的发育和繁殖。
A:实验设计。
B:断奶时CD-F1或LPD-F1的存活率。
C:F1雌性子代的体重轨迹(n CD_F1=13, n LPD_F1=12)。
D:F1子代的窝仔大小。
E:F1子代的自然排卵。
F:F2子代的出生体重。
G:F2雌性子代的体重轨迹(n CD_F2=12, n LPD_F2=10)。
H:F2子代的窝仔大小。
I:F3子代的出生体重。
(2)哺乳期母体低蛋白饮食(LPD)导致子代葡萄糖代谢紊乱
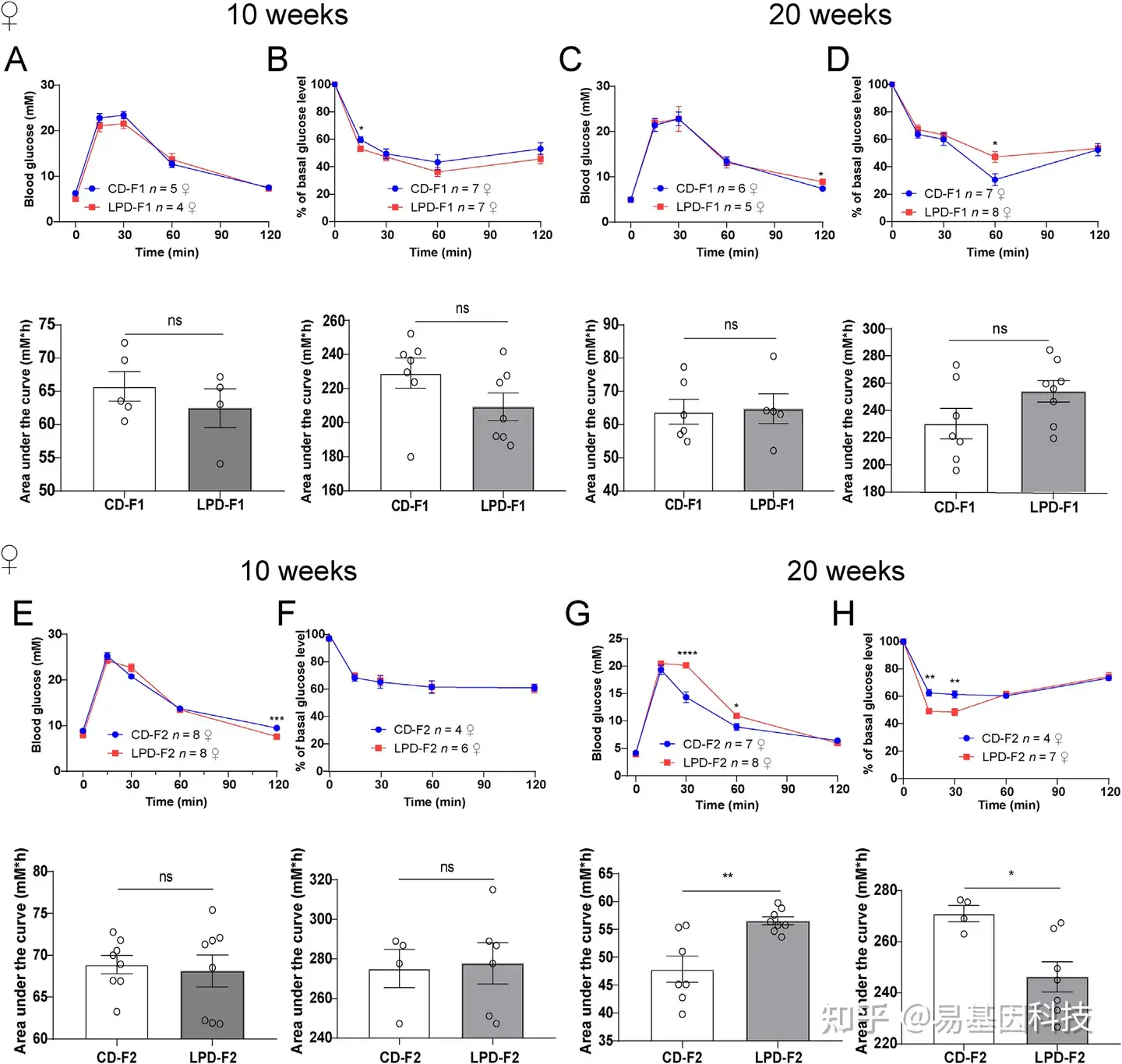
图2:10周和20周龄LPD-F1和LPD-F2雌性子代的葡萄糖耐量试验(GTT)和胰岛素耐量试验(ITT)。
(3)成年雌性F1子代的肠道微生物组变化。
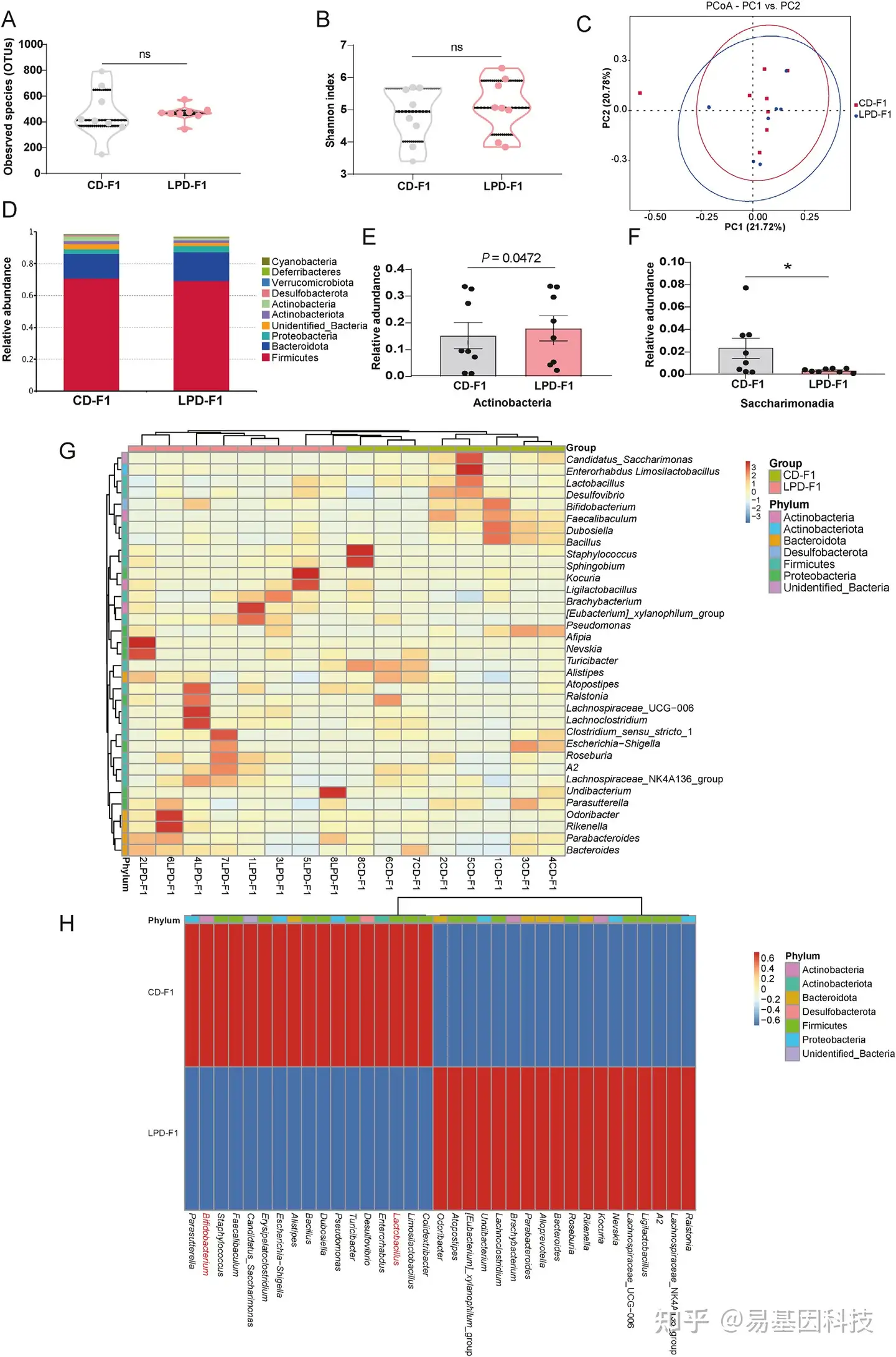
图3:成年LPD-F1子代(12周龄,n=8)的粪便微生物组变化。
(4)LPD-F1卵母细胞中的全基因组高甲基化。
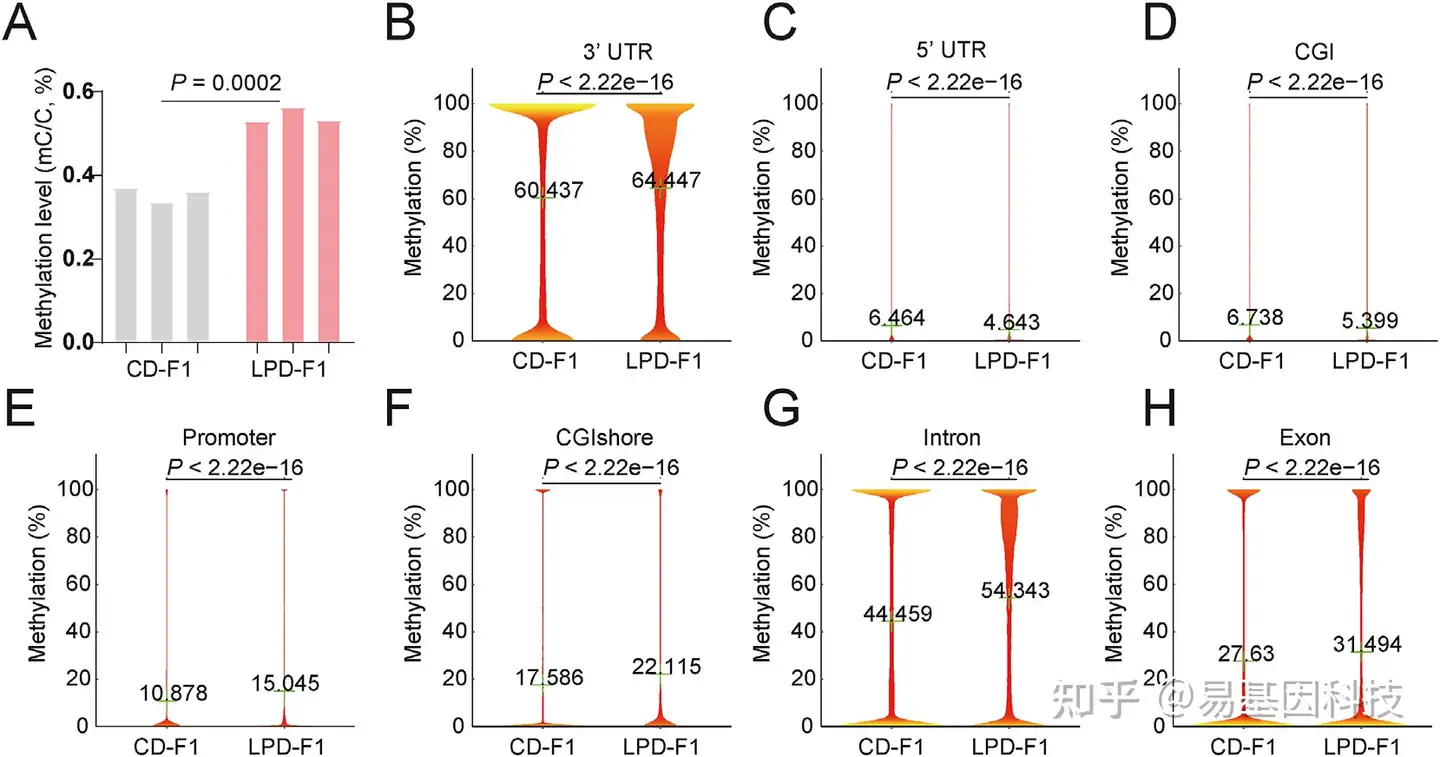
图4:LPD-F1卵母细胞中的整体DNA高甲基化
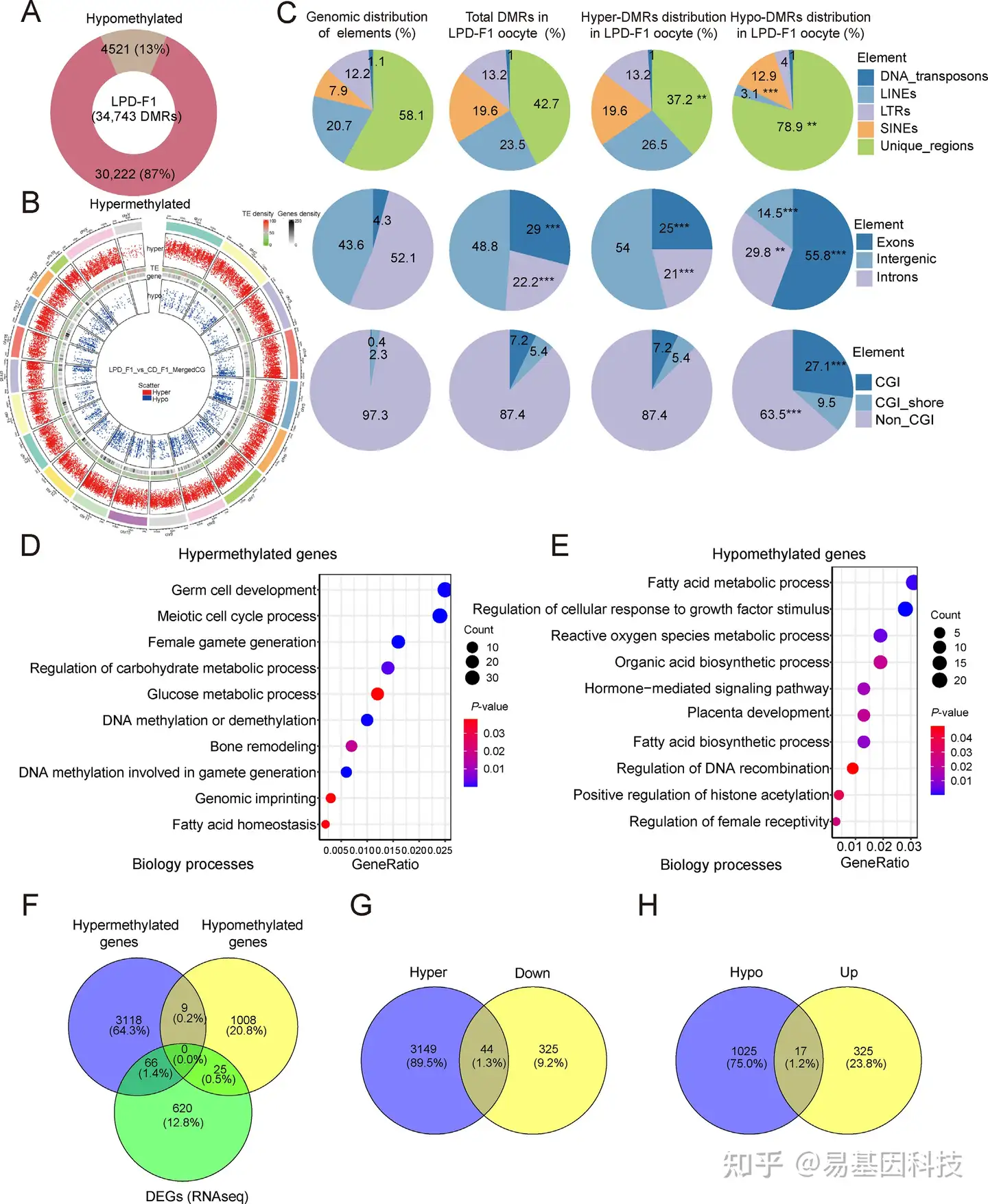
图5:LPD-F1卵母细胞中的差异甲基化区域(DMRs)分析。
A:LPD-F1卵母细胞中低甲基化和高甲基化DMRs比例。
B:DMRs在不同染色体上的分布。
C:饼图显示不同基因组区域中DMRs的分布。
D-E:启动子区高甲基化基因(D)和低甲基化基因(E)的GO分析。
F-H:维恩图表示不同甲基化基因与差异表达基因(DEGs,F)、高甲基化基因与下调基因(G)以及低甲基化基因与上调基因(H)之间的重叠。
DMRs,差异甲基化区域;GO,基因本体论;CGI,CpG岛;LINEs,长散在核元件;LTRs,长末端重复序列;SINEs,短散在核元件。
(5)F1代卵母细胞中变化的DNA甲基化部分传递给F2代卵母细胞。
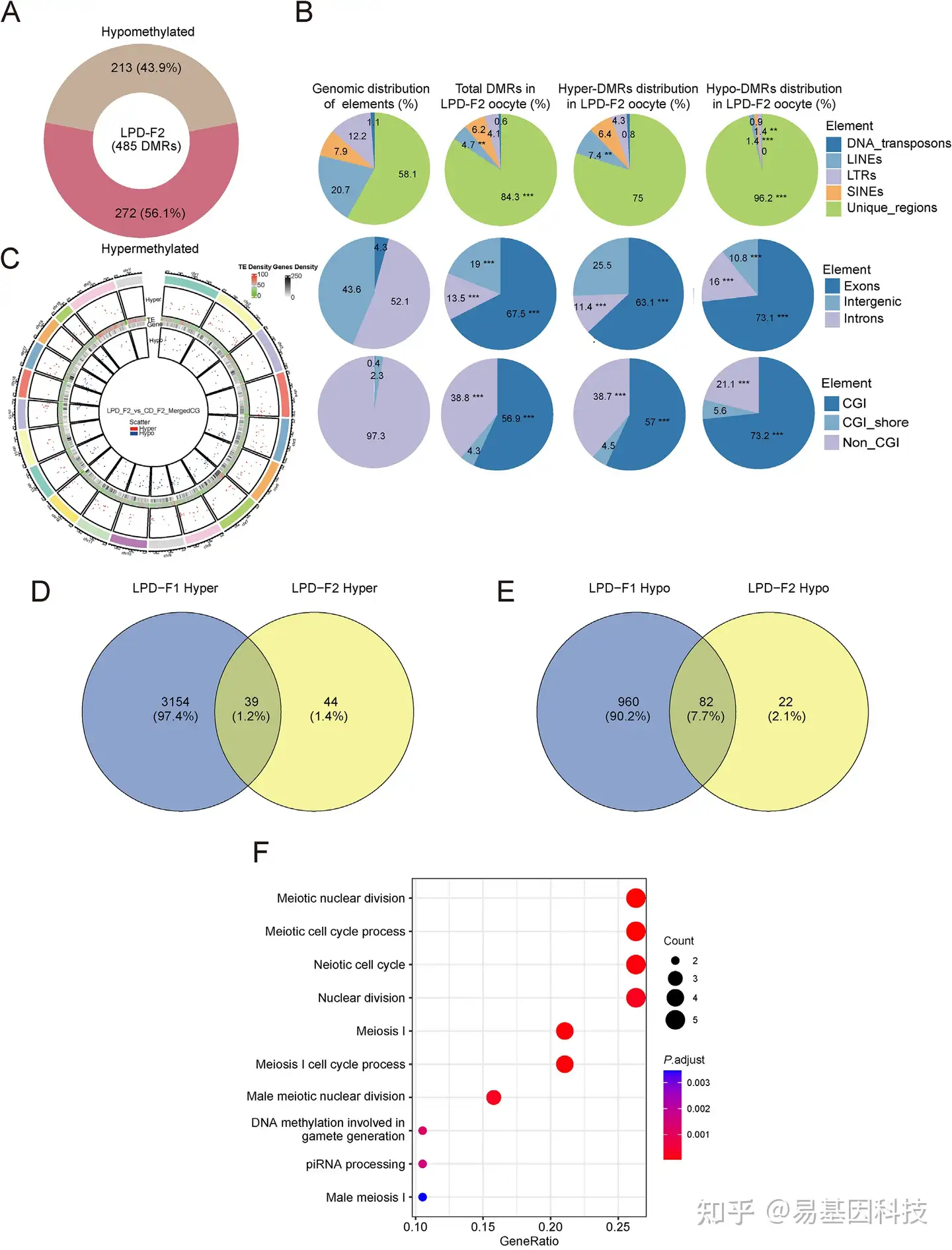
图6:LPD-F2卵母细胞中的差异甲基化区域(DMRs)分析。
A:LPD-F2卵母细胞中低甲基化和高甲基化DMRs比例。
B:DMRs在不同染色体上的分布。
C:饼图显示不同基因组区域中DMRs分布。
D:维恩图展示LPD-F1高甲基化基因与LPD-F2高甲基化基因的重叠。
E:维恩图展示LPD-F1低甲基化基因与LPD-F2低甲基化基因的重叠。
F:LPD-F1与LPD-F2之间重叠高甲基化基因的GO分析。
关于易基因单细胞及微量样本DNA甲基化测序(Micro DNA-BS)
单细胞及微量样本的DNA甲基化组学研究很大程度上受制于建库技术。传统的文库构建方法或类似于基因组DNA的单细胞扩增技术很难应用到甲基化实验过程中。易基因建立了一系列微量及单细胞甲基化检测方法,可对于不同项目需求,个性化提供检测方案,在全基因组、简化基因组、靶基因等范围开展甲基化检测。
易基因建立的单细胞及微量样本DNA甲基化测序技术包括:
- 单细胞全基因组甲基化测序(scWGBS)
- 单细胞简化基因组甲基化测序(scXRBS)
- 微量样本全基因组甲基化测序(Micro DNA-WGBS)
- 微量细胞或DNA简化基因组甲基化测序(Micro DNA-XRBS)
应用方向:
单细胞及微量珍稀样本的甲基化研究主要应用于肿瘤发生机制,癌症研究,胚胎植入前诊断,胚胎早期发育,生殖细胞重组,干细胞及细胞异质性等研究领域。应用的样本包括单细胞、微量细胞、微量DNA等。特别适用于难以取得的珍稀样本和细胞异质性较大的组织样本。
技术优势:
1)微量细胞或单细胞全基因组甲基化测序(Micro DNA-WGBS)DNA起始量:
单细胞/100-1000个细胞
1ng基因组DNA
90%以上基因组CG覆盖
2)微量细胞或DNA简化基因组甲基化测序(Micro DNA-XRBS)DNA起始量:
1ng基因组DNA;
10-20M有效CG位点覆盖;
20G测序数据量。

关于易基因单细胞转录组测序(smart-seq2)
时下火热的10X Genomics公司Chromium解决方案无法满足某些特殊或者少量细胞样本甚至单细胞转录组研究。Smart-seq2技术在单细胞水平对带Poly(A)的RNA进行全长转录组扩增及高通量测序,能够满足高灵敏度、低偏好性的cDNA扩增,得到全长转录本,实现高水平的序列模板转换。
Smart-seq2技术有较好的覆盖范围,可检测到稀有转录本,无需额外的专业设备,应用范围较广,可以解决传统 RNA 定量技术在早期胚胎发育、干细胞、癌症、免疫等研究领域中存在的样品量极低或细胞异质性的问题,是在单细胞水平研究基因表达强有力的工具,极大地拓展了RNA-seq 的应用范围。
技术优势:
(1)起始量低:1-1000个细胞或10pg-10ng total RNA即可高效扩增;
(2)转录本覆盖度高:通过双端引物扩增全长cDNA,获得全转录组信息,避免3’端和5’端偏好性,产物完整性好;
(3)检测灵敏度高:大幅度增加了低表达基因的检出量;
(4)碱基分辨率高:可达单碱基分辨率,且可以定位到具体基因的具体转录本;
(5)实验可控:质控点多,可从实验的开端判断细胞状况。
研究方向:
可应用于细胞分子机制中细胞异质性研究,解决因样本量少而无法进行高通量测序的情况。
- 免疫学研究
- 肿瘤及微环境研究
- 绘制组织精细化表达图谱
- 早期胚胎发育
实验策略:

易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化)和表观转录组学(m6A、m5C、m1A、m7G、ac4C)、染色质结构与功能组学技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900。
参考文献:
Gu LJ, Li L, Li QN, Xu K, Yue W, Qiao JY, Meng TG, Dong MZ, Lei WL, Guo JN, Wang ZB, Sun QY. The transgenerational effects of maternal low-protein diet during lactation on offspring. J Genet Genomics. 2024 Apr 22. pii: S1673-8527(24)00079-1. doi: 10.1016/j.jgg.2024.04.008. PubMed PMID: 38657948.
相关阅读:
项目文章|PNAS:中国农大田见晖教授团队揭示DNA甲基化保护早期胚胎线粒体基因组稳定性
项目集锦:微量样本及单细胞DNA甲基化研究如何发高分SCI文章(特别适用珍稀样本)
Cell|易基因微量DNA甲基化测序助力中国科学家成功构建胚胎干细胞嵌合体猴,登上《细胞》封面
Nature | 易基因DNA甲基化测序助力人多能干细胞向胚胎全能8细胞的人工诱导
标签:F1,DNA,子代,多组,卵母细胞,甲基化,跨代,LPD From: https://www.cnblogs.com/E-GENE/p/18420223