大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
卵巢癌是全球死亡率最高的妇科癌症,其中上皮性卵巢癌是最常见的卵巢癌类型。由于缺乏可靠的卵巢癌早期筛查,导致诊断延迟,5年生存率仅为50%。尽管近些年来治疗技术取得了进展,但由于其发病机制的基因调控网络不明确,卵巢癌的预后仍然很差。最近的研究表明,RNA修饰与疾病(包括癌症)发生和发展密切相关。5-甲基胞嘧啶(m5C)是一种常见的RNA修饰,其在转录后水平调控基因表达,但m5C RNA修饰与生物分子凝聚以及转录因子介导的转录调控之间的交互作用,在卵巢癌中的了解还很有限。
近期,重庆医科大学附属第三医院妇产中心易萍教授团队揭示了RNA甲基转移酶NSUN2促进mRNA m5C修饰,并与转录因子E2F1在卵巢癌中形成正反馈调控回路(positive feedback regulatory loop)。具体来说,NSUN2促进E2F1 mRNA m5C修饰并增加其稳定性,而E2F1与NSUN2启动子相结合,又反过来激活NSUN2转录。RNA结合蛋白YBX1作为m5C reader,参与NSUN2介导的E2F1调控。m5C修饰促进YBX1相分离,从而上调E2F1表达。卵巢癌中的NSUN2和YBX1被扩增和上调,而NSUN2和YBX1高表达表明卵巢癌患者预后较差。此外,E2F1转录调控癌基因MYBL2和RAD54L表达,从而推动卵巢癌进展。本研究绘制了一个由m5C修饰以依赖于YBX1相分离的方式调控NSUN2-E2F1-NSUN2循环,这可能是卵巢癌治疗的潜在靶点。相关研究成果以“RNA m5C modification upregulates E2F1 expression in a manner dependent on YBX1 phase separation and promotes tumor progression in ovarian cancer”为题发表在Nature子刊《Experimental & Molecular Medicine》上。

标题:RNA m5C修饰以依赖于YBX1相分离的方式上调E2F1表达,从而促进卵巢癌的肿瘤进展
期刊:Experimental & Molecular Medicine(Exp Mol Med)
影响因子:IF 9.5
发表时间:2024年3月1日
研究方法:
样本选择
2016年至2022年从重庆医科大学附属第三医院和大坪医院采集获得浆液性上皮性卵巢癌组织、输卵管上皮(fallopian tube epithelium, FTE)组织和正常卵巢上皮组织样本。
实验方法
研究使用了丰富的实验方法:
- 前期实验:多种细胞培养、肿瘤样本分析、质粒转染、慢病毒转导、蛋白表达和纯化、体外相分离实验、荧光恢复后光漂白(FRAP)实验、Western Blot分析、细胞增殖实验、Transwell实验、斑点印迹实验、免疫荧光(IF)和RNA荧光原位杂交(RNA-FISH);
- 多组学测序相互印证:RNA测序(RNA-seq)、RNA免疫沉淀和高通量测序(RIP-seq)、RNA亚硫酸盐测序(RNA-BisSeq)、染色质免疫沉淀(ChIP)和ChIP-seq;(易基因优势技术)
- 下游验证:增强UV交联免疫沉淀后PCR(eCLIP-PCR)、RNA半衰期检测、荧光素酶报告基因分析、Polysome分析。
研究思路
本研究通过收集卵巢癌组织和FTE组织,分析了RNA甲基转移酶NSUN2在卵巢癌中的表达,揭示NSUN2在卵巢癌中的过表达。通过功能获得实验和功能丧失实验验证NSUN2的致癌功能,并证实其通过调控细胞生长和细胞转移在卵巢癌中发挥作用。免疫荧光染色和GO分析揭示NSUN2在卵巢癌细胞中的定位和肿瘤相关调控通路。此外,通过RNA-BisSeq、RNA-seq、RIP-seq和ChIP-seq等技术分析了NSUN2介导的基因表达调控,并验证E2F1在NSUN2介导的卵巢癌进展中发挥至关重要的作用。
研究结果
(1)NSUN2在卵巢癌组织中过表达,NSUN2过表达与卵巢癌症患者预后不良相关
为研究m5C修饰在卵巢癌症中的作用,作者分析了14种m5C调控因子在TCGA队列中的表达。结果表明,多种m5C调节因子在卵巢癌症中失调,其中RNA甲基转移酶NSUN2表达变化最为显著,通常上调过表达。Kaplan-Meier分析显示,NSUN2表达上调与预后不良密切相关,主要通过调控细胞增殖和转移在卵巢癌中发挥致癌作用。
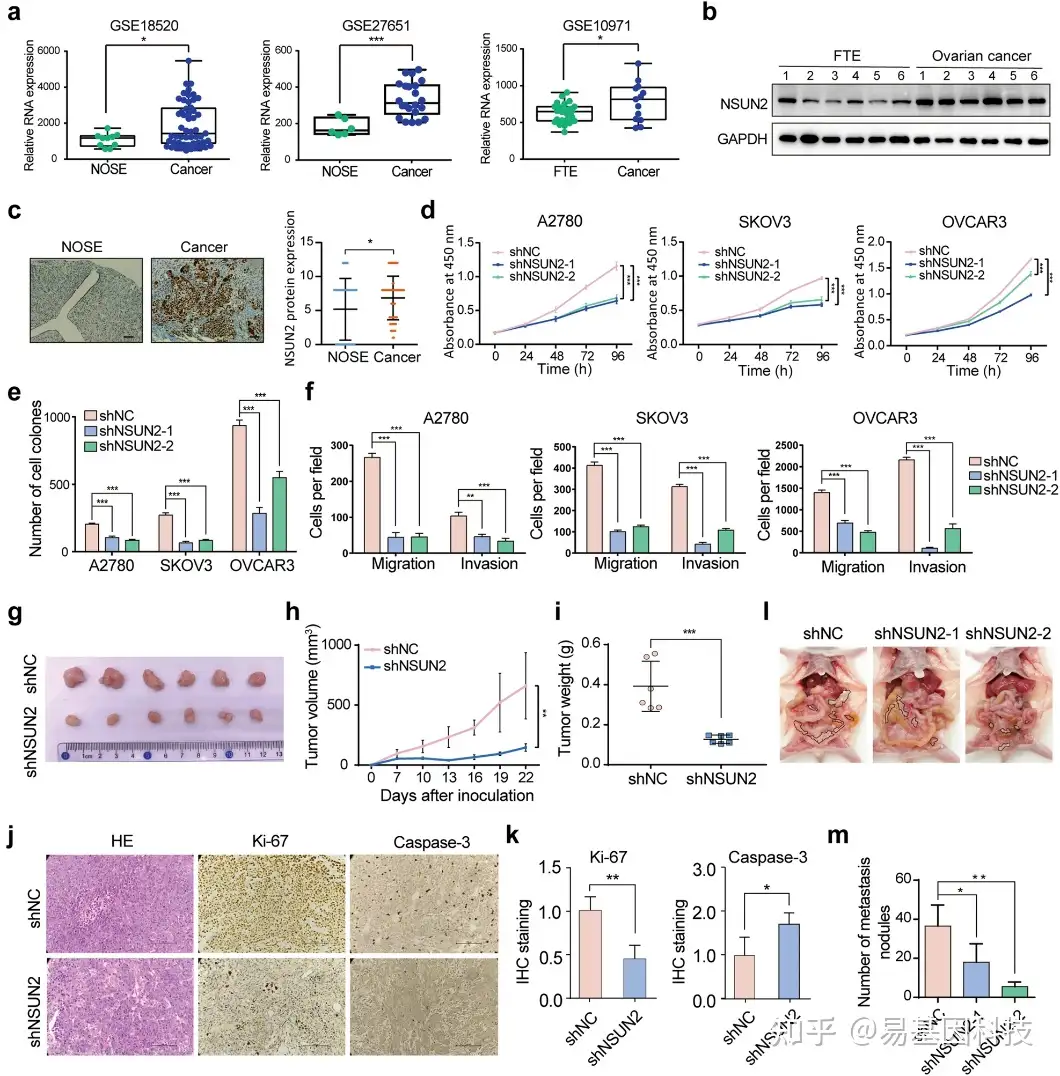
图1:NSUN2促进卵巢癌的肿瘤发生和转移。
- 根据GEO数据集(GSE19071、GSE18520和GSE27651),揭示NSUN2在卵巢癌中的RNA表达水平。
- 新鲜卵巢癌组织和输卵管上皮(FTE)组织中NSUN2蛋白的表达水平。
- 免疫组化分析卵巢表面上皮和卵巢癌组织中NSUN2蛋白的相对表达,并展示代表性免疫组化图像。
- CCK-8实验评估了NSUN2敲除对卵巢癌细胞生长的影响。
- 集落形成实验分析NSUN2敲除对卵巢癌细胞生长的影响。
- Transwell迁移和侵袭实验分析有或没有NSUN2表达的卵巢癌细胞的迁移和侵袭能力。
g–i. 通过小鼠异种移植模型分析有或没有NSUN2表达的卵巢癌细胞的肿瘤形成能力。将NSUN2敲除型和对照OVCAR3细胞皮下注射到小鼠中。每3天检测一次形成的肿瘤体积(h)。22天后切除形成的肿瘤(g),并检测肿瘤重量(i)。
j-k. 异种移植切片中Ki-67和Caspase-3表达的代表性图像和定量分析。
l-m. NSUN2敲除对卵巢癌细胞转移的影响,并定量分析在小鼠腹腔内形成的转移病灶。
(2)RNA-BisSeq揭示NSUN2促进卵巢癌症细胞m5C RNA修饰
鉴于已经证实NSUN2能够催化mRNA m5C修饰,作者首先通过免疫荧光染色检测了 NSUN2 在卵巢癌细胞中的定位。随后使用特异性靶向m5C修饰RNA的抗体进行斑点印迹实验,以确认 NSUN2 是否调控整体mRNA m5C修饰。为了确定由NSUN2介导的特异性mRNA m5C修饰,作者通过RNA-BisSeq 在 NSUN2敲除后的卵巢癌细胞中全转录组范围内绘制了单碱基分辨率下的m5C修饰变化。分析结果表明,NSUN2敲除后,6192个RNAs的16536个位点上的m5C修饰减少,这些m5C修饰位点被鉴定为卵巢癌细胞中的高甲基化位点。NSUN2敲除后全局m5C修饰水平也有所下降。卵巢癌细胞中m5C位点的中位甲基化百分比约为30%,大多数转录本的m5C百分比低于40%。约80% m5C修饰转录本是mRNA(图2c)。与之前的研究结果一致,m5C位点主要在富含CG序列中富集,最富集区域是外显子,同时非翻译区(UTRs)和翻译起始位点(起始C)在内的其他区域也受m5C修饰。m5C位点倾向于分布在mRNA转录本的5'-UTRs和起始密码子中,与在小鼠胚胎干细胞和大脑中的发现一致,但在非编码RNA转录本的5'和3'端富集。在对照和NSUN2敲除的卵巢癌细胞中,mRNA转录本中m5C位点的分布特征没有显著差异。对卵巢癌细胞中高甲基化m5C转录本的GO分析表明,与肿瘤相关的调控通路在这些转录本中富集。
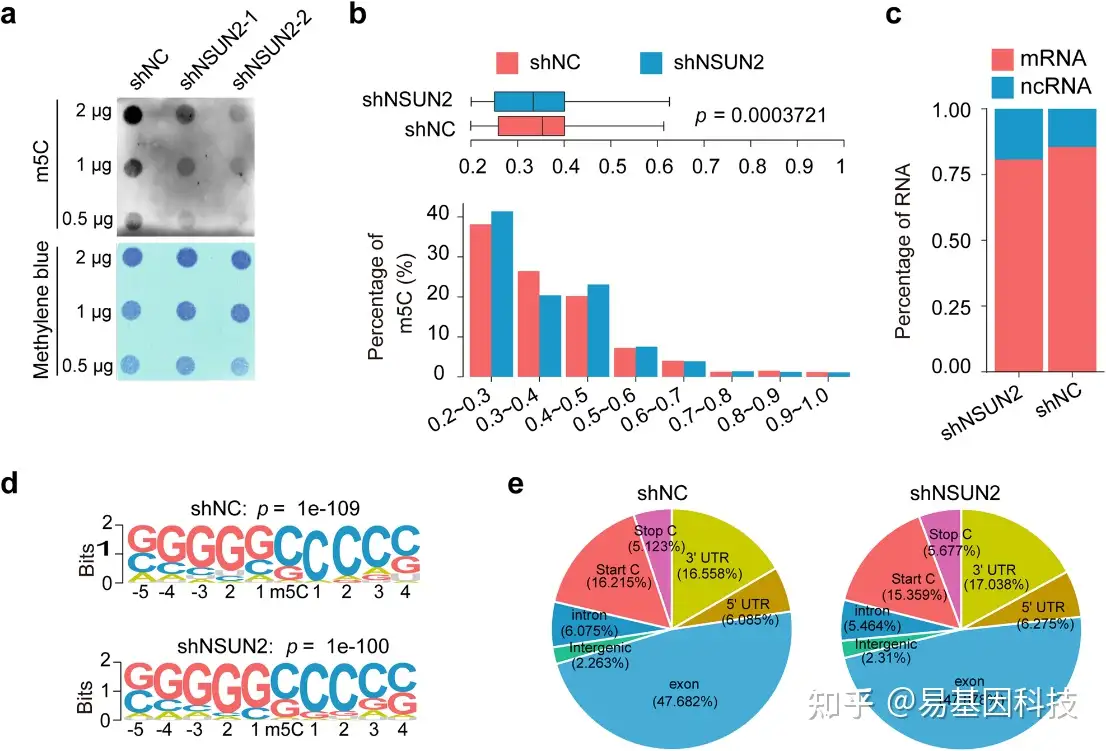
图2:NSUN2介导卵巢癌细胞中的mRNA m5C修饰。
- 斑点印迹图显示了卵巢癌细胞中NSUN2敲除后整体mRNA m5C修饰变化。
- 柱状图和箱线图显示有或没有NSUN2过表达的卵巢癌细胞中mRNA m5C水平分布。
- 不同种类RNA转录本中,m5C修饰位点的转录本所占比例。
- HOMER算法分析显示mRNA m5C位点相邻序列的保守性序列标志图(Logoplot)。
- 在有或没有NSUN2过表达的卵巢癌细胞中高甲基化m5C peaks的转录组范围分布。饼状图显示了m5C位点在不同mRNA区域(包括编码序列CDS、内含子、5'-UTR、3'-UTR、起始密码子和终止密码子)中的比例。
这些数据表明NSUN2对卵巢癌细胞中mRNA的m5C修饰水平有显著影响,且m5C修饰在mRNA的不同区域有不同的分布模式。
(3)多组学策略揭示了 NSUN2 在卵巢癌中的靶点
为进一步探索NSUN2介导的基因表达调控,作者对NSUN2敲除的卵巢癌细胞进行RNA测序(RNA-seq),并对卵巢癌细胞进行RNA结合蛋白免疫沉淀测序(RIP-seq)。测序分析结果表明,在卵巢癌细胞中,NSUN2敲除导致1744个基因表达变化,RIP-seq显示NSUN2能够与2842个转录本结合。GO分析揭示通过RNA-seq和RIP-seq鉴定的转录本被富集在不同的信号通路中。约72.5%的NSUN2结合转录本是蛋白质编码RNA。通过对RNA-seq、RIP-seq和RNA-BisSeq数据的综合分析,鉴定出163个转录本作为NSUN2的潜在靶点(图3d)。
为进一步确定NSUN2介导的基因调控机制,使用比值比(OR)来评估m5C高甲基化RNA或NSUN2结合转录本与NSUN2敲除卵巢癌细胞中差异表达基因(DEGs)之间的相关性。结果显示m5C修饰的RNA和NSUN2结合的RNA在NSUN2敲除后倾向下调表达,表明NSUN2正向调控其靶标基因的表达。通过累积分析揭示卵巢癌细胞中m5C高甲基化的RNA在NSUN2敲除后同样下调,NSUN2结合亲和力高的RNA也表现出m5C高甲基化,在NSUN2敲除细胞中表达降低。GO分析显示163个候选NSUN2标靶中,81个下调基因在与转录调控相关的通路中富集。因此,这些数据表明NSUN2能够促进mRNA的m5C修饰,并正向调控其表达。
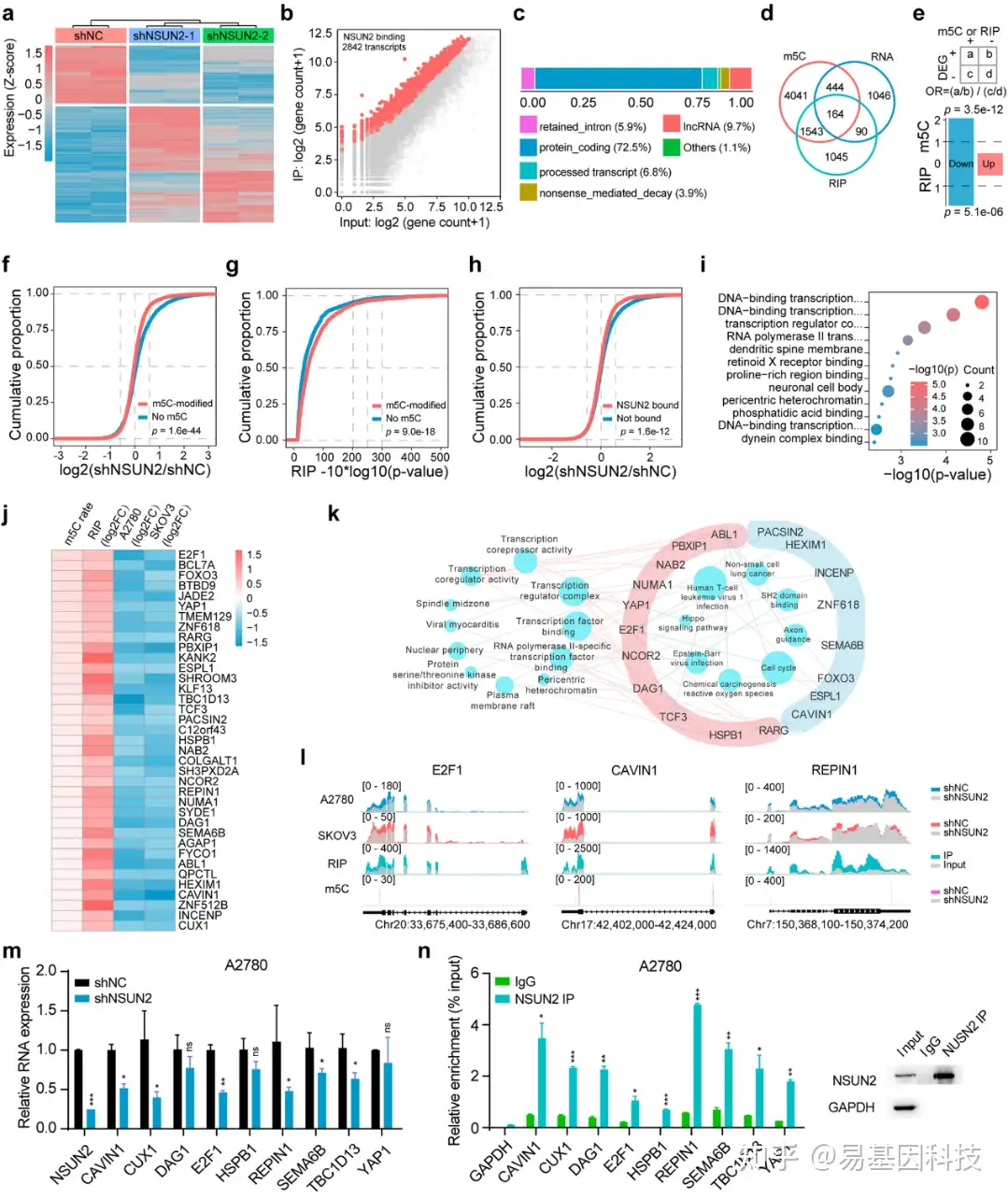
图3:转录组范围鉴定NSUN2标靶。
- 与对照A2780细胞相比,NSUN2敲除细胞中差异表达基因(DEGs)热图。
- 点阵图显示NSUN2结合的转录本。对NSUN2进行RIP-seq后,通过斑点印迹实验分析input组和IP组的基因计数。
- 分析NSUN2结合转录本类型。
- RNA-BisSeq(m5C)、RNA-seq(RNA)和NSUN2 RIP-seq(RIP)数据鉴定的RNA重叠维恩图。
- 上图:计算比值比公式。下图:NSUN2敲除后,NSUN2结合与非结合转录本以及高甲基化m5C峰转录本DEGs比值比。
- 累积曲线图显示NSUN2沉默后卵巢癌细胞中高甲基化m5C峰变化。
- 累积曲线图显示卵巢癌细胞中高甲基化m5C峰对NSUN2结合的作用。
- 累积曲线图揭示NSUN2沉默后卵巢癌细胞中NSUN2结合转录本的变化。
- 对NSUN2敲除细胞中81个下调基因进行GO功能富集分析。
- 根据多组学综合分析结果,卵巢癌细胞中NSUN2的关键标靶热图。
- 基于GO分析的37个NSUN2关键标靶的功能性注释。外环粉红色表示与转录相关术语。
- Metagene图显示NSUN2敲除以及NSUN2结合时卵巢癌细胞中m5C位点和RNA丰度分布。
- RT-qPCR检测NSUN2敲除后A2780细胞中NSUN2标靶的RNA水平。
- RIP-PCR评估NSUN2与其标靶转录本之间的互作。
为缩小卵巢癌细胞中NSUN2靶标范围,在NSUN2敲除后的SKOV3细胞中进行了RNA-seq测序,并通过生物信息学分析鉴定出1748个基因被NSUN2敲除显著调控。在这些卵巢癌细胞系中,差异表达基因(DEGs)之间表现出中等程度相关性,且这些DEGs与m5C高甲基化转录本和NSUN2结合的转录本也有重叠。通过对SKOV3细胞中726个下调的转录本、被NSUN2占据的下调转录本、以及A2780细胞中m5C修饰的转录本综合分析,鉴定出37个基因作为NSUN2的关键靶标。对这些靶标基因的功能注释分析显示,主要是与转录相关的术语在这些基因中富集,这与上述在A2780卵巢癌细胞中靶标功能分析结果一致。在这些候选基因中选择一组与肿瘤形成相关的基因来验证NSUN2的调控效应。由RNA-BisSeq确定的m5C位点以及由RNA-seq确定的RNA表达谱,通过RT-qPCR和RIP-PCR检测验证NSUN2敲除后靶标基因表达变化以及NSUN2与这些基因互作。
(4)NSUN2和YBX1以m5C依赖性方式调控E2F1 mRNA稳定性
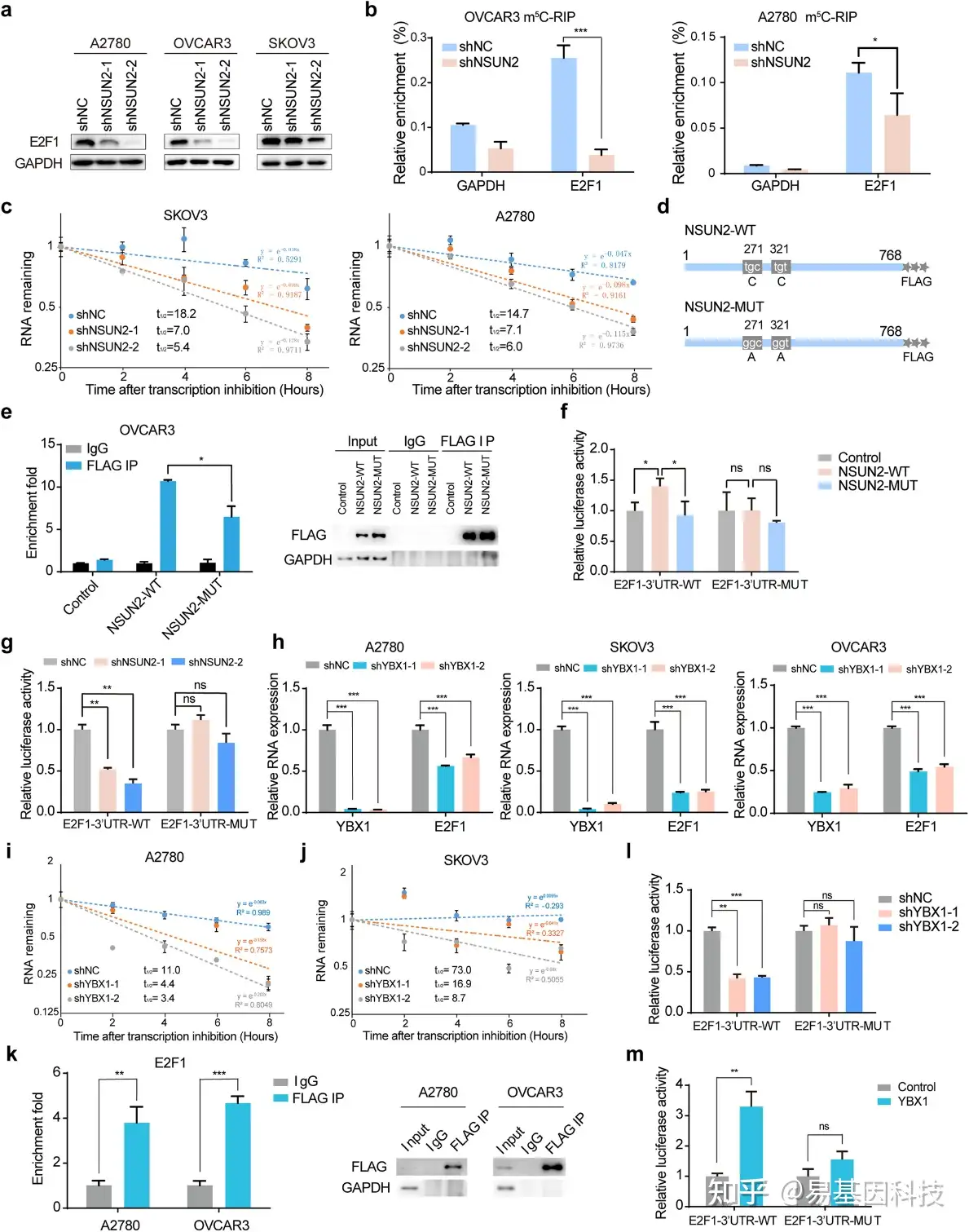
图4:E2F1表达受NSUN2和YBX1以m5C依赖性方式调控。
- 卵巢癌NSUN2敲低细胞E2F1蛋白表达的Western Blot分析。
- m5C-RIP实验后,RT-qPCR验证NSUN2介导E2F1 mRNA m5C修饰。
- 在NSUN2敲除卵巢癌细胞中评估E2F1 mRNA半衰期。
- 带有FLAG标签的野生型NSUN2和催化活性缺失的NSUN2示意图。
- RIP-PCR实验验证NSUN2及其突变体与E2F1 mRNA的互作。
- 在共表达NSUN2或NSUN2突变体的细胞中,检测并比较携带野生型E2F1 3'-UTR或m5C位点缺失的E2F13'-UTR的相对荧光素酶活性报告基因,并将其归一化为Renilla荧光素酶活性。
- 在对照和NSUN2敲除的卵巢癌细胞中,检测并比较携带野生型E2F1 3'-UTR或m5C位点缺失的E2F1 3'-UTR的相对荧光素酶活性报告基因。
- 在卵巢癌细胞中YBX1缺失后检测了E2F1表达。
- YBX1敲除对卵巢癌细胞中E2F1 mRNA半衰期的影响。
- YBX1敲除对SKOV3细胞中E2F1 mRNA半衰期的影响。
- RIP-PCR结果验证YBX1与E2F1 mRNA的相互作用。
- 在对照和YBX1缺失的卵巢癌细胞中,检测并比较携带野生型E2F1 3'-UTR或m5C位点缺失的E2F1 3'-UTR的相对荧光素酶活性报告基因,并将其归一化为Renilla荧光素酶活性。
- 在共表达YBX1的HEK293T细胞中,检测并比较携带野生型E2F1 3'-UTR或m5C位点缺失的E2F1 3'-UTR的相对荧光素酶活性报告基因,并将其归一化为Renilla荧光素酶活性。
(5)YBX1在卵巢癌中经历相分离并上调
YBX1在卵巢癌细胞中经历液相分离,可以形成液滴结构并调控受m5C修饰的RNA命运。NSUN2敲除破坏YBX1液滴形成,而m5C修饰的RNA可以增强YBX1液相分离。
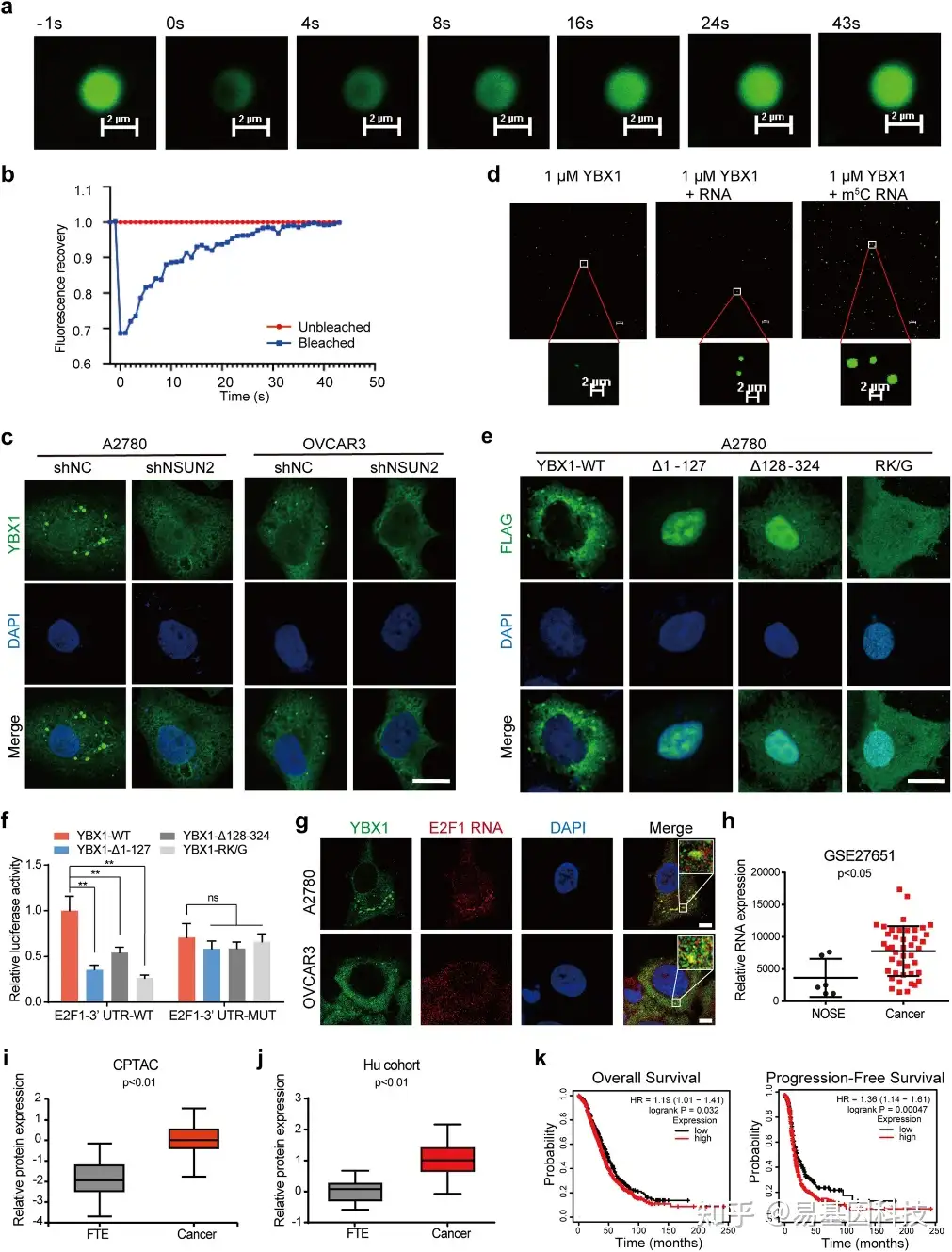
图5:YBX1冷凝(condensation)调控E2F1表达。
- 荧光恢复的代表性图像。
- 对(a)中所示的FRAP检测结果进行定量分析。
- YBX1免疫荧光成像显示,在NSUN2敲除后卵巢癌细胞形成YBX斑点。
- YBX1蛋白与m5C修饰RNA或非m5C修饰RNA的相分离。
- 对GFP融合的YBX1及不同YBX1突变体的免疫荧光成像。
- 共表达YBX1或其突变体的HEK293T细胞中,检测并归一化了携带野生型E2F1 3'-UTR或带有m5C位点缺失的E2F1 3'-UTR的相对荧光素酶活性报告基因。
- 结合RNA FISH和免疫荧光(IF)用于检测E2F1 mRNA与YBX1凝聚体的共定位。
- 根据GSE27651数据集,卵巢癌样本中YBX1的RNA表达。
- CPTAC数据集中卵巢癌组织和输卵管上皮(FTE)组织中YBX1的蛋白表达。
- Hu队列中卵巢癌和FTE组织中YBX1的蛋白表达。
- YBX1表达与卵巢癌患者总生存期和无进展生存期的关联Kaplan-Meier分析。
(6)ChIP-seq等揭示E2F1转录调控NSUN2表达
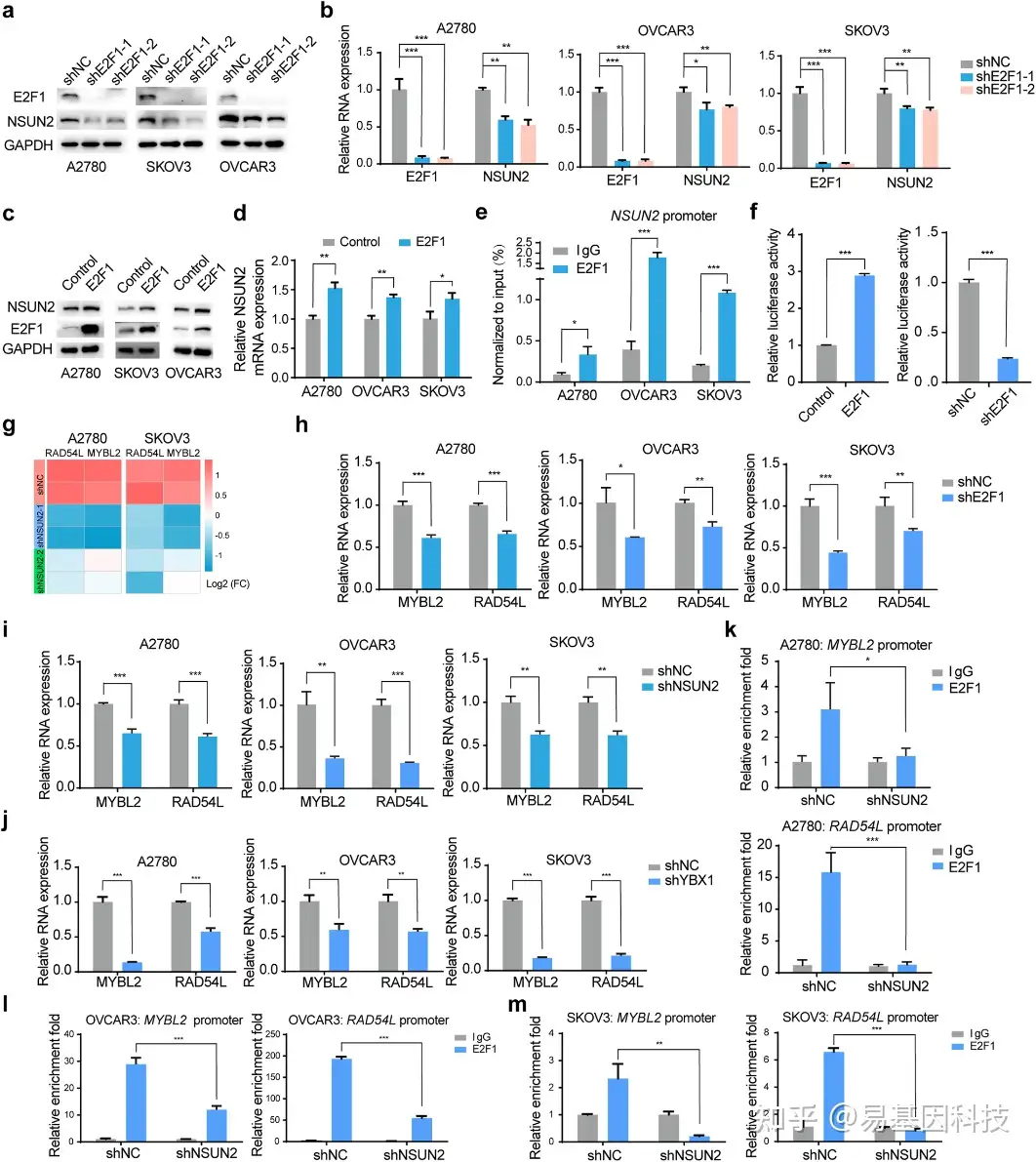
图6:E2F1转录调控NSUN2表达。
- E2F1缺失卵巢癌细胞的NSUN2蛋白丰度。
- E2F1缺失卵巢癌细胞的NSUN2 RNA水平。
- E2F1过表达卵巢癌细胞的NSUN2蛋白表达。
- E2F1过表达卵巢癌细胞的NSUN2 RNA水平。
- ChIP-seq实验结果证实E2F1与卵巢癌细胞NSUN2启动子之间的相互作用。
- 在HEK293T和SKOV3细胞中,检测E2F1过表达或敲除的NSUN2启动子相对荧光素酶活性报告基因,并将该活性归一化为Renilla荧光素酶活性。
- 卵巢癌细胞中NSUN2敲除后MYBL2和RAD54L表达变化热图。
- 卵巢癌细胞中E2F1或NSUN2表达丧失后,验证了MYBL2和RAD54L RNA水平。
j. YBX1调控卵巢癌细胞中MYBL2和RAD54L表达。
k. 在对照和NSUN2敲除的A2780卵巢癌细胞中进行E2F1 ChIP-seq实验,以检测NSUN2是否影响E2F1在MYBL2和RAD54L启动子处的富集。
l. 在对照和NSUN2敲除的OVCAR3和SKOV3细胞中进行E2F1 ChIP-seq实验,以检测NSUN2是否影响E2F1与MYBL2和RAD54L启动子的结合。
(7)E2F1与NSUN2的肿瘤促进功能密切相关
为进一步验证E2F1在NSUN2介导的卵巢癌进展中的影响,作者在NSUN2敲除的卵巢癌细胞中进行挽救试验。
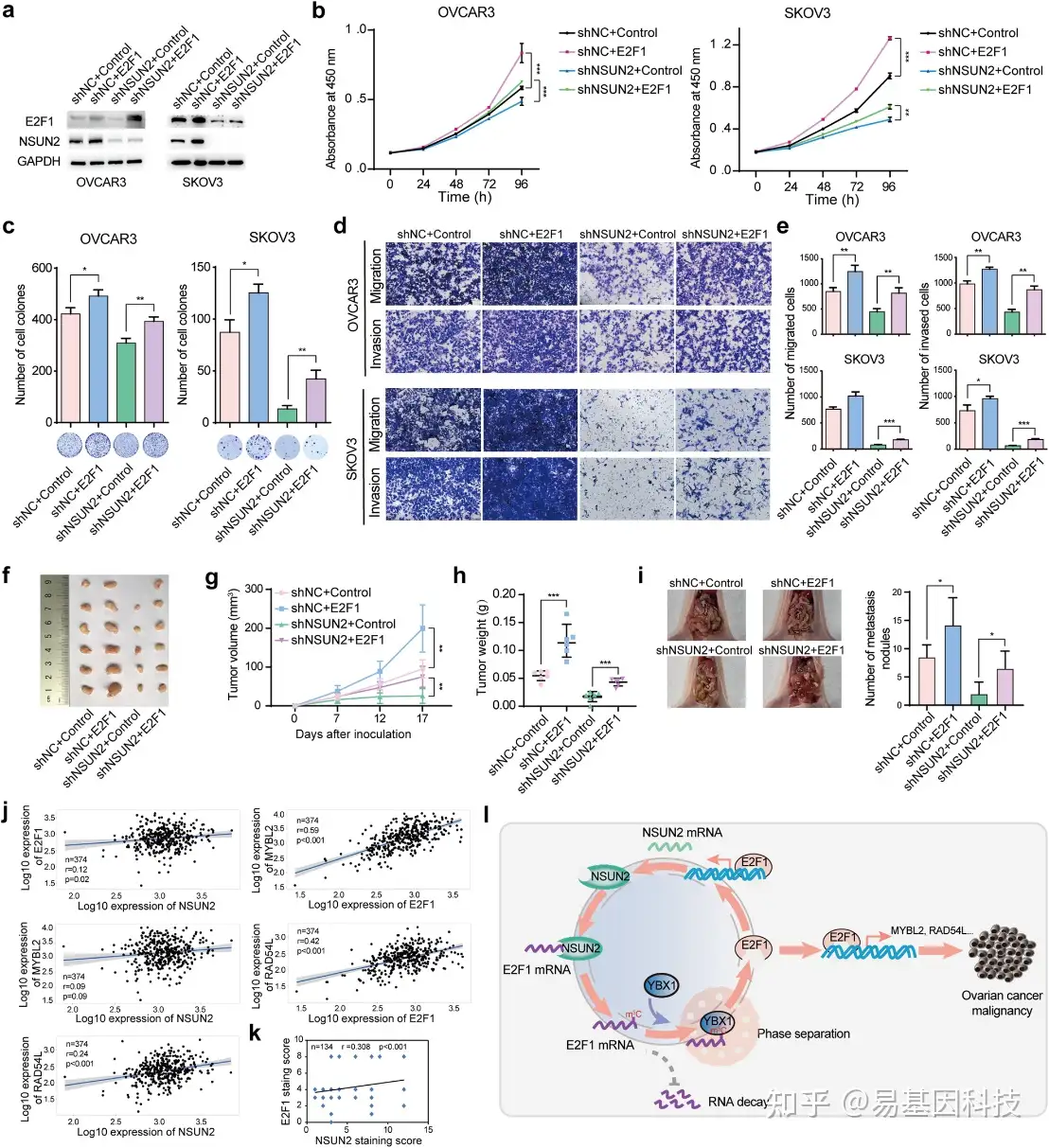
图7:E2F1异位表达减轻了NSUN2缺失对卵巢癌的抑制作用。
- NSUN2敲除卵巢癌细胞中重新表达E2F1时的E2F1表达情况Western Blot分析。
- CCK-8实验结果表明,强制表达E2F1促进NSUN2敲除的卵巢癌细胞生长。
- 在NSUN2敲除的卵巢癌细胞中重新表达E2F1促进细胞集落形成。
d-e. 强制表达E2F1对NSUN2缺失的卵巢癌细胞迁移和侵袭的作用。
f-h. 利用小鼠异种移植模型评估了有或没有NSUN2过表达后再过表达E2F1的卵巢癌细胞肿瘤生长情况,并对形成的肿瘤体积和重量进行检测。
- 评估有或没有NSUN2过表达后再过表达E2F1的卵巢癌细胞转移到小鼠腹腔的情况。
j. 分析NSUN2与E2F1、NSUN2与MYBL2、NSUN2与RAD54L之间的表达相关性,以及E2F1与MYBL2和E2F1与RAD54L之间的表达相关性。
k. 通过组织芯片分析,对卵巢癌患者(n=134)中NSUN2与E2F1蛋白表达之间的Spearman等级相关性进行分析。
l. 提出卵巢癌NSUN2-E2F1调控网络模型。
易小结
本研究通过丰富的实验,既有体外和体内实验相结合,同时又结合多组学(RNA-BisSeq、RNA-seq、RIP-seq和ChIP-seq等技术)研究分析。揭示了RNA甲基转移酶NSUN2在卵巢癌中高表达,预示着不良预后。E2F1可以调控NSUN2转录,NSUN2转录增多,促进了肿瘤细胞的m5C甲基化,RNA m5C修饰以依赖于YBX1相分离的方式上调E2F1表达。E2F1的mRNA m5C甲基化,被相分离形成聚合的YBX1结合,维持E2F1稳定性,促进E2F1表达,激活肿瘤增殖。从而形成 NSUN2-E2F1-NSUN2 正反馈回路,为卵巢癌治疗提供有前途的靶点。
主要发现:
- RNA甲基转移酶NSUN2促进m5C修饰E2F1 mRNA,增加其稳定性。
- E2F1与NSUN2启动子结合,反过来激活NSUN2转录,形成正反馈调控回路。
- RNA结合蛋白YBX1作为m5C reader,参与NSUN2介导的E2F1调控。
- m5C修饰促进YBX1相分离,进而上调E2F1表达。
关于易基因RNA m5C甲基化测序(RNA-BS)技术
m5C是RNA百余种修饰中研究较多的一种。m5C存在于tRNA上时,可以对翻译进行调节;存在于rRNA上时,可以对核糖体的生物合成进行质控;存在于mRNA上时,则可以影响mRNA的结构、稳定性及翻译过程。
易基因提供适用于不同科研需求的m5C甲基化测序技术:
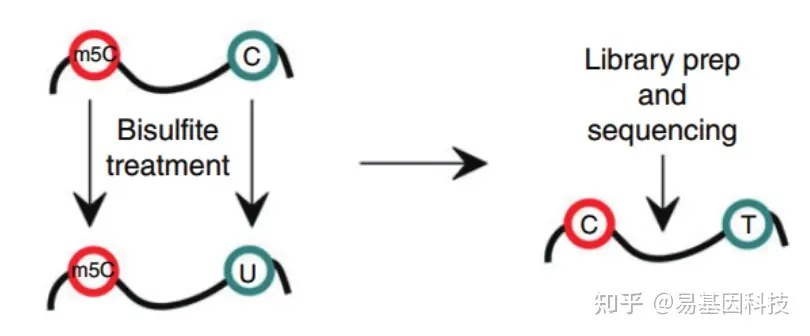
- 常规mRNA m5C甲基化测序(RNA-BS):
mRNA分离后首先通过亚硫酸盐处理,非甲基化的C转变为U,m5C修饰的碱基保持不变,结合高通量测序,可以对RNA上的每一个C碱基修饰进行定位与定量。 - 常规mRNA +lncRNA m5C甲基化测序(全转录组RNA-BS):
易基因科技建立的升级版m5C RNA甲基化测序服务,去除人rRNA后,剩余RNA经重亚硫酸盐处理后,结合高通量NGS策略,可在全转录组范围内单碱基分辨率地检测基因m5C甲基化修饰分布。
技术优势:
- 高深度:超高深度重亚硫酸盐处理,检测准确性极高;
- 高通量:结合高通量NGS,全转录组范围内检测;
- 单碱基:单碱基分辨率,快速检测和分析RNA中的m5C。
- 高准确:精确的检测mRNA等每一个C碱基的的修饰水平。
研究方向:
- 与m6A甲基化类似,m5C甲基化已被证明与肿瘤、神经系统紊乱、代谢性疾病、病毒感染以及个体发育等密切相关。
- 此外,RNA甲基化(m5C)与人类疾病密切相关,其功能涉及调控干细胞应激、细胞毒性应激、mRNA出核和植物细胞发育及基因表达等方面。
关于易基因染色质免疫共沉淀测序 (ChIP-seq)
染色质免疫共沉淀(Chromatin Immunoprecipitation,ChIP),是研究体内蛋白质与DNA相互作用的经典方法。将ChIP与高通量测序技术相结合的ChIP-Seq技术,可在全基因组范围对特定蛋白的DNA结合位点进行高效而准确的筛选与鉴定,为研究的深入开展打下基础。
DNA与蛋白质的相互作用与基因的转录、染色质的空间构型和构象密切相关。运用组蛋白特定修饰的特异性抗体或DNA结合蛋白或转录因子特异性抗体富集与其结合的DNA片段,并进行纯化和文库构建,然后进行高通量测序,通过将获得的数据与参考基因组精确比对,研究人员可获得全基因组范围内某种修饰类型的特定组蛋白或转录因子与基因组DNA序列之间的关系,也可对多个样品进行差异比较。
应用方向:
ChIP 用来在空间上和时间上不同蛋白沿基因或基因组定位
- 转录因子和辅因子结合作用
- 复制因子和 DNA 修复蛋白
- 组蛋白修饰和变异组蛋白
技术优势:
- 物种范围广:细胞、动物组织、植物组织、细菌微生物多物种富集经验;
- 微量建库:只需5ng以上免疫沉淀后的DNA,即可展开测序分析;
- 方案灵活:根据不同的项目需求,选择不同的组蛋白修饰特异性抗体。
技术路线:
参考文献:
Liu X, Wei Q, Yang C, Zhao H, Xu J, Mobet Y, Luo Q, Yang D, Zuo X, Chen N, Yang Y, Li L, Wang W, Yu J, Xu J, Liu T, Yi P. RNA m5C modification upregulates E2F1 expression in a manner dependent on YBX1 phase separation and promotes tumor progression in ovarian cancer. Exp Mol Med. 2024 Mar 1. pii: 10.1038/s12276-024-01184-4. doi: 10.1038/s12276-024-01184-4. PubMed PMID: 38424195.
相关阅读:
项目文章 | Adv Sci:NSUN2介导m5C修饰代谢重编程促进肿瘤进展 揭示治疗新选择
项目文章 | NAR:RCMS编辑系统在特定细胞RNA位点的靶向m5C甲基化和去甲基化研究
项目文章:泪腺RRBS+RNA-seq揭示Sjögren综合征相关干眼症的潜在基因
项目文章 | 组蛋白ChIP-seq揭示烟粉虱共生菌Hamiltonella调控宿主生殖新机制
标签:E2F1,Nature,RNA,NSUN2,测序,细胞,m5C,卵巢癌 From: https://www.cnblogs.com/E-GENE/p/18386300