大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
中药小檗碱(Berberine,BBR,化学式C20H18NO4)是从几种药用植物中分离出的一种异喹啉季生物碱,包括小檗(Berberis aristata)和黄连(Coptis chinensis)。小檗碱可改善脂质代谢紊乱诱导的细胞氧化应激、凋亡和自噬,但其分子机制尚不清楚。
斑马鱼(Danio rerio,Cyprinidae)是发育、遗传和繁殖的重要脊椎动物模式生物。肝脏是脂肪合成的主要器官,鱼类体内约90%的脂肪在肝脏中合成,肝脏在维持碳水化合物、氨基酸和脂肪酸的代谢平衡中发挥着重要作用。有许多研究使用斑马鱼肝细胞(Zebrafish hepatocyte,ZFL)来研究体外脂肪沉积。
2022年11月30日,上海交通大学徐维娜团队在《Antioxidants》杂志发表题为“Berberine Regulation of Cellular Oxidative Stress, Apoptosis and Autophagy by Modulation of m6A mRNA Methylation through Targeting the Camk1db/ERK Pathway in Zebrafish-Hepatocytes”的研究论文,该研究以斑马鱼肝细胞(ZFL)作为代谢综合征合并氧化应激研究的模型系统,通过MeRIP-seq等实验揭示了m6A RNA甲基化修饰在体外用小檗碱处理的ZFL脂质沉积中的作用。

标题:Berberine Regulation of Cellular Oxidative Stress, Apoptosis and Autophagy by Modulation of m6A mRNA Methylation through Targeting the Camk1db/ERK Pathway in Zebrafish-Hepatocytes(小檗碱通过靶向斑马鱼肝细胞中的Camk1db/ERK通路介导m6A mRNA甲基化以调控细胞氧化应激、凋亡和自噬)
时间:2022.11.30
期刊:Antioxidants
影响因子:IF 7.675
技术平台:MeRIP-seq、RNA-seq、MeRIP -PCR、Western Blot等
研究摘要
为理解BBR改善脂质代谢紊乱诱导的细胞氧化应激、凋亡和自噬相关分子机制,本研究分析了m6A甲基化修饰在脂质沉积斑马鱼肝细胞(ZFL)中的作用。结果表明,BBR促进肝细胞m6A RNA甲基化水平发生变化,增加Camk1db基因转录本的m6A水平并改变Camk1db基因的mRNA表达。通过敲除Camk1db基因,Camk1db可促进细胞ERK磷酸化水平。小檗碱通过改变Camk1db基因的m6A RNA甲基化来调控Camk1db mRNA表达水平,进而影响钙调蛋白依赖性蛋白激酶合成和ERK信号通路激活,从而导致下游ROS产生、细胞增殖、凋亡和自噬等生理指标发生变化。本研究结果表明小檗碱可以通过靶向斑马鱼肝细胞中的Camk1db/ERK通路介导Camk1db m6A甲基化,从而调控细胞氧化应激、凋亡和自噬。
 示意图:小檗碱介导Camk1db/ERK1/2信号通路机制
示意图:小檗碱介导Camk1db/ERK1/2信号通路机制
研究结果
1、小檗碱对棕榈酸钠诱导的脂肪沉积斑马鱼肝细胞氧化应激、凋亡和自噬的调控
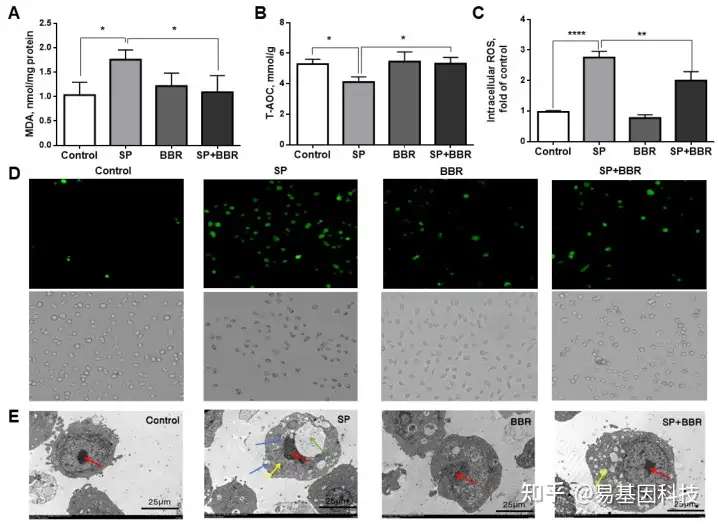
图1:ZFL内不同处理组氧化应激指标及ZFL透射电镜图。
(A) MDA(丙二醛)。(B) T-AOC(总抗氧化能力)。(C) ROS相对表达。(D) ROS荧光显微镜图片。
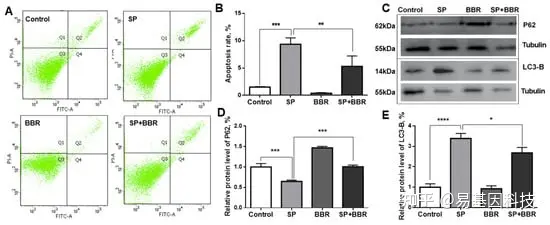
图2:小檗碱对棕榈酸钠诱导的肝细胞凋亡和自噬的影响。
(A) 流式细胞术检测ZFL细胞凋亡,每组细胞计数为10000。(B) ZFL的凋亡和凋亡率。(C) P62蛋白和LC3-B蛋白的WB图。(D) P62蛋白相对表达水平。(E) LC3-B蛋白相对表达水平。
2、小檗碱在棕榈酸钠诱导斑马鱼肝细胞m6A甲基化及转录水平中的作用
(1)m6A甲基化分析
从四个实验组收集细胞:对照组(control)、脂质沉积组(SP)、小檗碱组(BBR)和脂质沉积+小檗碱组(SP+BBR),采用MeRIP-seq高通量测序进行甲基化分析,以研究小檗碱对脂质沉积诱导斑马鱼细胞m6A甲基化的影响。如下表所示,在甲基化位点数上,小檗碱组检测到的甲基化位点最多,其次是脂质沉积+小檗碱组和对照组,脂质沉积组检测到的甲基化位点最少。结果表明,脂质沉积和小檗碱的添加会影响斑马鱼肝细胞m6A甲基化位点数量。
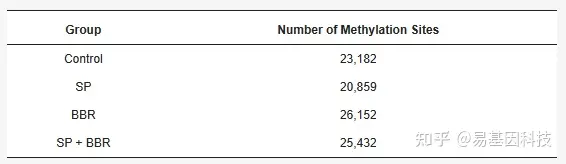
表1:4个实验组的甲基化位点数量比较
为研究m6A位点在mRNA上的分布,根据m6A peaks在转录本上的分布将其分为四个区域:5'非翻译区(5'UTR)、3'非翻译区(3'UTR)、第一外显子(1st Exon)和其他外显子(Other Exon)。结果表明,大多数m6A peaks位于3'UTR区,其次是5'UTR区和Other Exon区。与对照组相比,脂质沉积组3''UTR和5''UTR区m6A peaks显著增加,而添加小檗碱后3'UTR区m6A peaks显著降低,5'UTR区的m6A peaks进一步增加。m6A peaks具有较高的富集倍性,表明脂质沉积诱导的斑马鱼肝细胞具有不同的m6A甲基化模式,且添加适量的小檗碱改变了这些m6A甲基化模式。
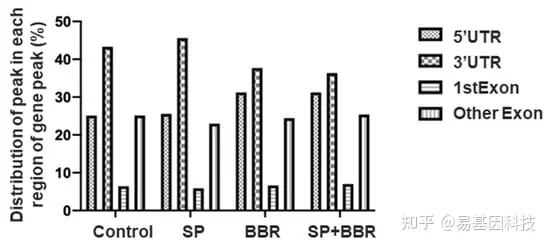
图3:ZFL中各组m6A peaks分布
RNA的甲基化和去甲基化过程需要蛋白与甲基化位点motif的结合。对于四组样品的motif预测,使用分析软件HOMER用于在peaks区域中寻找高度可行性的motif。分析结果在四组中多次出现和高度相似的motif,揭示了斑马鱼甲基化位点的潜在motif。结果表明,4个不同处理组均含有“RRACH”motif,表明斑马鱼也符合其他物种的一般模式,证实了本实验结果的可靠性,可用于后续分析。
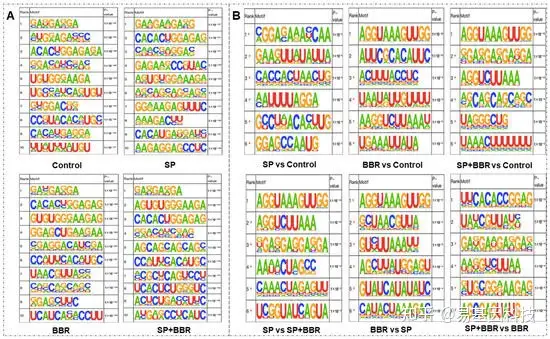
图4:m6A甲基化分析。
(A) ZFL中不同处理组的前十个motif分析。(B) 每组前六位motif分析*-可能为假阳性。
(2)转录组分析
从四个实验装置组收集细胞用于转录组分析:对照(control),脂质积累组(SP),小檗碱组(BBR)和脂质积累+小檗碱组(SP+BBR)。

图5:各组转录差异基因的KEGG富集分析。
(A) SP组与对照组比较。(B) BBR组与对照组比较。(C)SP+BBR组与对照组比较。(D) SP+BBR组与SP组比较。(E)BBR组与SP组比较。(F)SP+BBR组与BBR组比较。
(3)m6A甲基化组和转录组关联分析
对于转录水平和甲基化水平的相关性分析,分别分析了各组的甲基化水平和转录水平变化基因数量,以及各组同时在甲基化水平和转录水平存在显著差异的基因数量,还对甲基化水平和转录水平的显著差异基因进行KEGG通路富集分析(图6)。
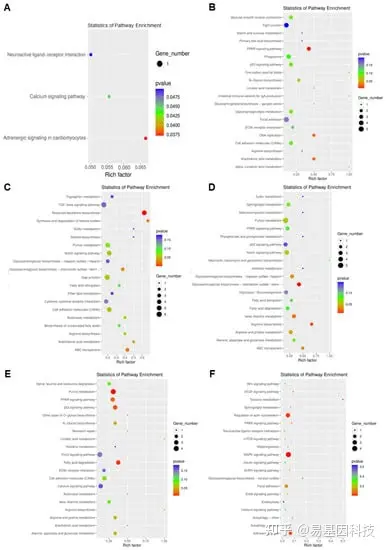
图6:各组甲基化和转录水平差异显著基因的KEGG富集分析。
(A) SP组与对照组比较。(B) BBR组与对照组比较。(C) SP+BBR组与对照组比较。(D) SP+BBR组与SP组比较。(E)BBR组与SP组比较。(F)SP+BBR组与BBR组比较。
(4)靶基因筛选
甲基化-转录水平关联分析的筛选过程主要靶向甲基化水平显著变化和转录水平显著差异的基因(p<0.05)(Fc≥2)。从中筛选出斑马鱼的Camk1db基因作为下一步研究的候选基因。与对照组相比,脂质沉积组Camk1db基因的m6A RNA甲基化水平显著降低,转录水平降低但无显著差异。小檗碱组的甲基化水平和转录水平显著高于脂质沉积组。与脂质沉积组相比,脂质沉积+小檗碱组的甲基化水平和转录水平也显著增加。
3、Camk1db基因甲基化及其对ZFL细胞稳态调控的验证
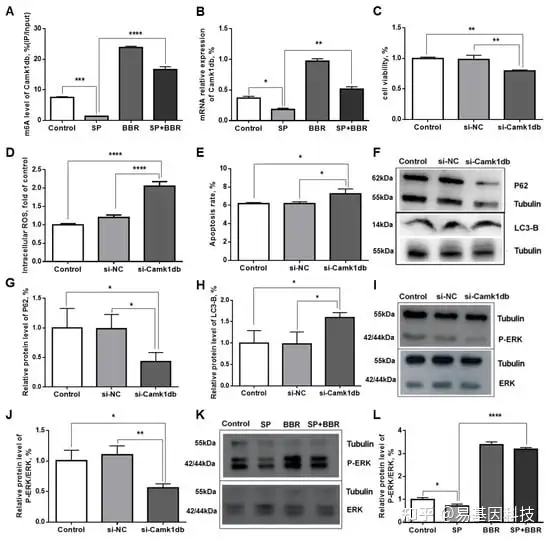
图7:验证Camk1db基因甲基化及其对ZFL细胞内稳态的调控作用。
(A)ZFL中Camk1db基因的m6A甲基化水平。(B)Camk1db基因在ZFL中的相对mRNA表达。(C)肝细胞活性。(D)细胞内ROS相对表达。(E)细胞凋亡率。(F)LC3-B和P62蛋白的WB图。(G)P62蛋白的相对含量。(H)LC3-B蛋白的相对含量。(I,J)P-ERK/ERK蛋白转染前后的WB图和相对水平。(K,L)不同处理组(对照组、SP组、BBR组、SP+BBR组)P-ERK/ERK蛋白的WB 图和相关蛋白表达。
结论:
本研究探讨了小檗碱对棕榈酸钠诱导的ZFL细胞氧化应激、凋亡和自噬等生物学功能的影响,同时确定了细胞RNA m6A甲基化的新方向,筛选出关键差异基因Camk1db。研究结果为鱼类养殖业中保肝中草药的研究与开发提供分子理论基础。然而,仍然存在一些尚未解决的问题。有必要阐明m6A甲基化在体内氧化应激过程调控中的作用。
关于易基因RNA m6A甲基化测序(MeRIP-seq)技术
易基因MeRIP-seq技术利用m6A特异性抗体富集发生m6A修饰的RNA片段(包括mRNA、lncRNA等rRNA去除所有RNA),结合高通量测序,可以对RNA上的m6A修饰进行定位与定量,总RNA起始量可降低至10μg,最低仅需1μg总RNA。广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症发生与发展、药物应答等研究领域;可应用于动物、植物、细胞及组织的m6A检测。
大样本量m6A-QTL性状关联分析,传统MeRIP单个样品价格高,通常难以承担。易基因开发建立MeRIP-seq2技术,显著提成IP平行性,实现不同样本间相对定量,降低检测成本。
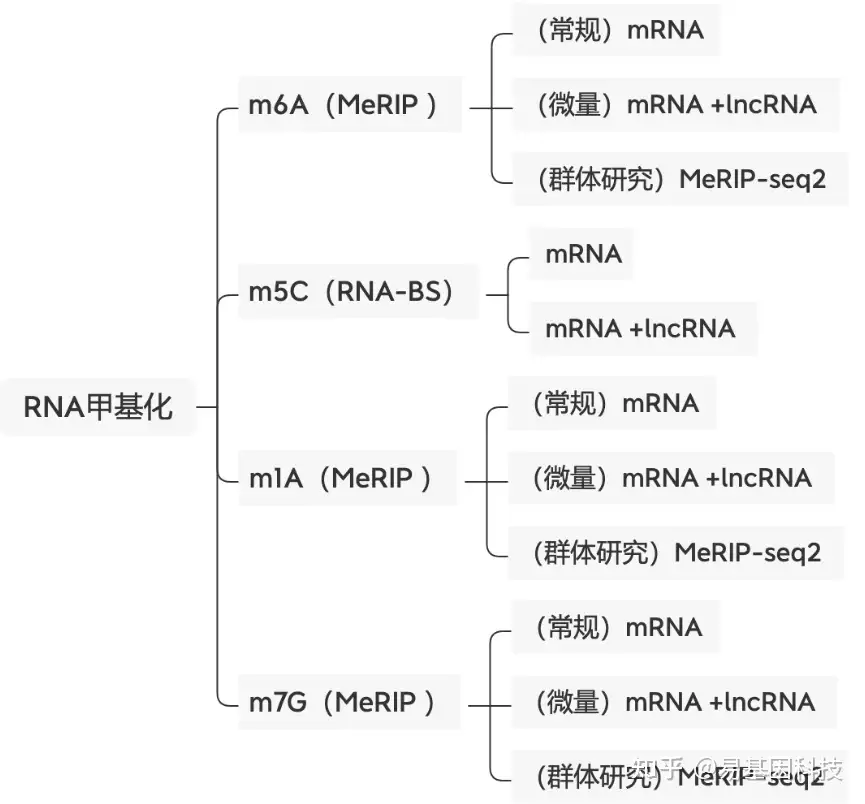
易基因提供适用于不同科研需求的MeRIP技术:
- m6A甲基化-常量mRNA 甲基化测序(MeRIP-seq)
- m6A甲基化-常量mRNA +lncRNA甲基化测序(lnc-MeRIP-seq)
- m6A甲基化-微量mRNA +lncRNA甲基化测序(Micro-lnc-MeRIP-seq)
- 高通量m6A甲基化-常量mRNA甲基化测序(MeRIP-seq2)
技术优势:
- 起始量低:样本起始量可降低至10-20μg,最低仅需1μg总RNA;
- 转录组范围内:可以同时检测mRNA和lncRNA;
- 样本要求:可用于动物、植物、细胞及组织的m6A检测;
- 重复性高:IP富集重复性高,最大化降低抗体富集偏差;
- 应用范围广:广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症的发生与发展、药物应答等研究领域。
研究方向:
m6A甲基化目前主要运用在分子机制的理论性研究
- 疾病发生发展:肿瘤、代谢疾病(如肥胖/糖尿病)、神经和精神疾病(如阿尔兹海默症/抑郁症)、炎症…
- 发育和分化:早期胚胎发育、个体/组织/器官生长发育、干细胞分化与命运决定、衰老
- 环境暴露与响应:污染、抗逆、生活方式
关于m6A甲基化研究思路
(1)整体把握m6A甲基化图谱特征:m6A peak数量变化、m6A修饰基因数量变化、单个基因m6A peak数量分析、m6A peak在基因元件上的分布、m6A peak的motif分析、m6A peak修饰基因的功能分析
(2)筛选具体差异m6A peak和基因:差异m6A peak鉴定、非时序数据的分析策略、时序数据的分析策略、差异m6A修饰基因的功能分析、差异m6A修饰基因的PPI分析、候选基因的m6A修饰可视化展示
(3)m6A甲基化组学&转录组学关联分析:Meta genes整体关联、DMG-DEG对应关联、m6A修饰目标基因的筛选策略
(4)进一步验证或后期试验
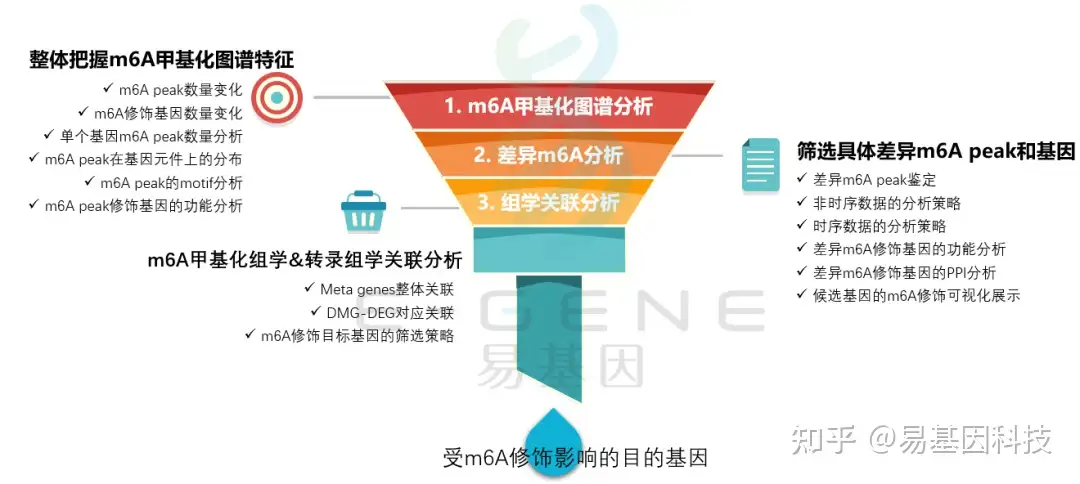
易基因科技提供全面的RNA甲基化研究整体解决方案。
参考文献:
Zhang M, Liu J, Yu C, Tang S, Jiang G, Zhang J, Zhang H, Xu J, Xu W. Berberine Regulation of Cellular Oxidative Stress, Apoptosis and Autophagy by Modulation of m6A mRNA Methylation through Targeting the Camk1db/ERK Pathway in Zebrafish-Hepatocytes. Antioxidants (Basel). 2022 Nov 30;11(12) pii: antiox11122370.
相关阅读:
项目集锦 | 易基因近期m⁶A甲基化(MeRIP-seq)研究成果
项目文章 | 90天见刊,易基因m⁶A RNA甲基化(MeRIP)+转录组组学研究
干货:m⁶A RNA甲基化MeRIP-seq测序分析实验全流程解析
技术推介|RNA m⁶A甲基化测序(MeRIP-seq)技术介绍
 标签:凋亡,m6A,SP,基因,斑马鱼,甲基化,小檗,BBR
From: https://www.cnblogs.com/E-GENE/p/17460962.html
标签:凋亡,m6A,SP,基因,斑马鱼,甲基化,小檗,BBR
From: https://www.cnblogs.com/E-GENE/p/17460962.html