大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
发育通常被认为是遗传程序的顺序展开,复杂程度不断提高,并按固定轨迹随时间进行。然而,调整发育时间可以提高在不利条件下的存活率。在哺乳动物中,这表现为胚胎停育。在小鼠胚泡和胚胎干细胞中,通过抑制mTOR表达以及对Myc转录因子的抑制可诱导胚胎转入暂停多能性的休眠状态,其特点是生物合成活动(包括基因转录)水平大幅下降,但目前对暂停的胚胎干细胞和囊胚的转录休眠的诱导机制尚未完全阐明。
在所有已知的mRNA修饰中,N6-甲基腺苷(m6A)甲基化是真核生物mRNA中最丰富的修饰,甲基通过甲基转移酶复合物沉积在新生RNA上,Mettl3是催化活性亚基,通过破坏关键细胞命运调节因子(包括Klf4、Nanog和Sox2)的mRNA稳定性,在植入后发育过程中发挥重要作用。
2023年9月7日,加拿大多伦多大学Miguel Ramalho-Santos和Evelyne Collignon团队在《nature cell biology》杂志发表题为“m6A RNA methylation orchestrates transcriptional dormancy during paused pluripotency”的研究论文,该研究旨在探索RNA修饰在休眠期转录休眠调控中的潜在功能,通过m6A MeRIP–seq、ChIP-seq、RNA-seq等测序分析,揭示了m6A RNA甲基化协调多能性暂停期间的转录休眠机制。

标题:m6A RNA methylation orchestrates transcriptional dormancy during paused pluripotency(m6A RNA甲基化协调多能性暂停期间的转录休眠)
时间:2023-09-07
期刊:nature cell biology
影响因子:IF 21.3 / 1区
技术平台:MeRIP-seq、ChIP-seq、RNA-seq等
研究摘要:
在后生动物谱系中,胚胎可以进入可逆的发育暂停或滞育状态,以应对不利的环境条件。这种显著休眠状态下的分子机制仍不清楚。本研究表明Mettl3引起的N6-甲基腺苷(m6A) RNA甲基化是小鼠囊胚和胚胎干细胞(ES)发育暂停所必需的。Mettl3通过两个相互关联的机制导致转录休眠:(1)促进整体mRNA的不稳定:(2)通过破坏转录放大器(transcriptional amplifier)和癌基因N-Myc的mRNA稳定性来抑制整体新生转录,而N-Myc是关键的抗暂停因子。敲低N-Myc挽救了Mettl3-/- ES细胞的暂停,暂停的野生型ES细胞中Mycn mRNA的强制去甲基化和稳定在很大程度上再现了Mettl3-/- ES细胞的转录缺失。这些发现揭示了Mettl3是发育暂停期间转录组和表观转录组调控互作的关键协调者,对成体干细胞休眠和癌症具有重要意义。
技术方法
本研究应用MeRIP-seq,ChIP-seq,RNA-seq等技术,通过敲除N-Myc以及抑制 mTOR 诱导胚胎干细胞暂停发育等手段,探索RNA修饰在休眠期转录休眠调控中的潜在功能,发现小鼠胚泡和胚胎干(ES)细胞的发育暂停需要 Mettl3 对 N6 -甲基腺苷(m6A)RNA 进行甲基化,并且揭示了Mettl3对发育暂停期间的整体转录起抑制作用,其染色质招募增加是m6A RNA甲基化增加的原因。

重要结果
(1)Mettl3是暂停多能性所必需
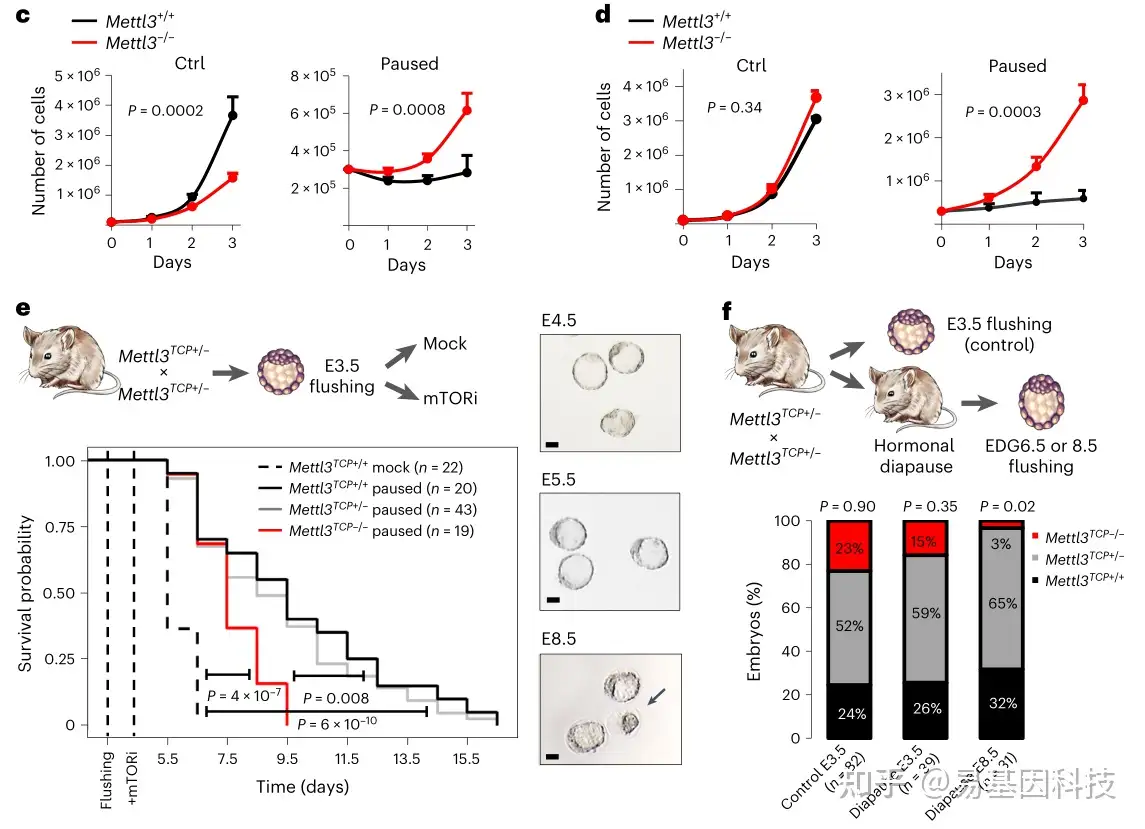
图1:m6A甲基转移酶 Mettl3对暂停的多能性至关重要
c-d. 生长曲线显示,在含有胎牛血清和白血病抑制因子的培养基(FBS/LIF)(c)和添加 GSK3β 和 Mek 1/2 抑制剂的培养基(FBS/LIF/2i)(d)中,Mettl3-/-ES 细胞在暂停条件下无法抑制增殖
e. Mettl3 缺失导致暂停条件下体内外培养的小鼠胚泡过早死亡(下);黑色箭头表示死亡胚胎(右)
f. E3.5(对照组)或激素停育后等效妊娠天数(EDG)6.5 和 8.5 的复苏(活)胚胎数量,显示 Mettl3TCP-/- 胚胎激素停育受损(下)
(2)Mettl3是转录休眠所必需
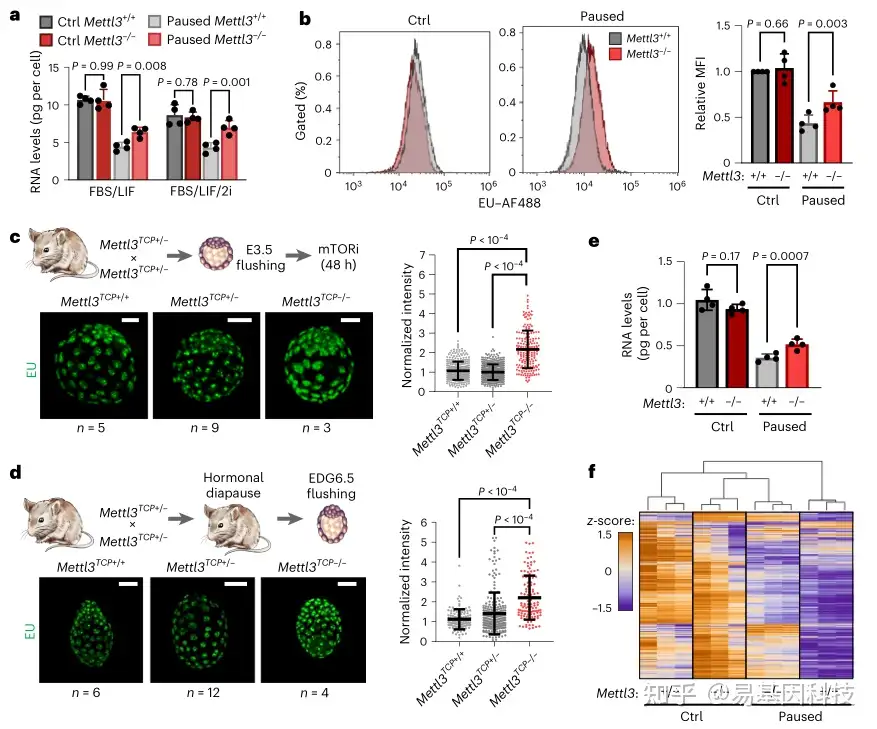
图2:Mettl3 在暂停多能性过程中调控低转录
b. 在对照或暂停条件下生长的 Mettl3+/+ 和 Mettl3-/- ES 细胞新生转录的代表性直方图(左),以及每个实验中相对于对照 Mettl3+/+ 细胞的中位荧光强度 (MFI) 定量(右),显示暂停的 Mettl3-/- ES 细胞转录增加
c-d. 免疫荧光图像(左)和核信号定量(右),5-乙炔基尿嘧啶(EU)在体外暂停(c)和激素刺激(d)囊胚中的掺入,显示 Mettl3TCP-/- 细胞中新生转录增加
f. Mettl3+/+和Mettl3-/- ES细胞中所有基因表达热图(RNA-seq),显示暂停的Mettl3-/- ES细胞中存在低转录缺陷
(3)Mettl3 通过其甲基转移酶活性维持休眠
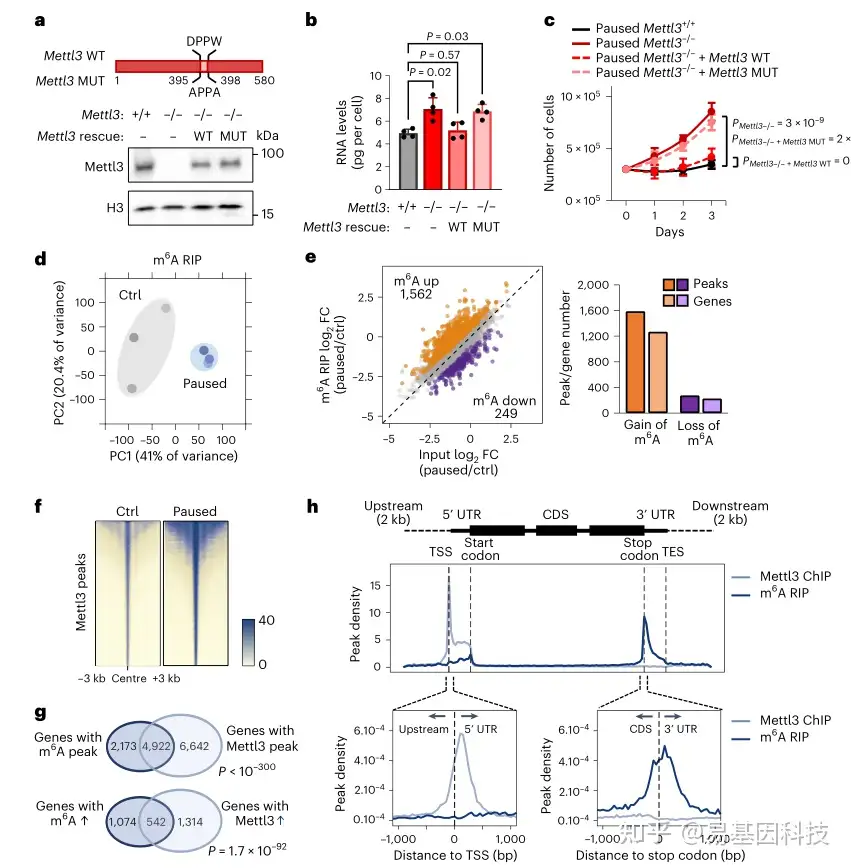
图3:Mettl3的甲基转移酶活性可维持暂停的多能性
b-c. 转染 WT Mettl3,而非其催化突变体,可恢复暂停 Mettl3-/- (pMettl3-/-) ES 细胞体外低转录(b)和增殖受抑制(c)的暂停表型
d. MeRIP-seq 所有样本中所有 m6A peaks的 PCA 图,显示暂停的 ES 细胞具有独特的 m6A 特征
f. 对照组和暂停 ES 细胞中 Mettl3 ChIP-seq 信号的热图,显示暂停 ES 细胞中 Mettl3 结合增加
(4)Mettl3 在发育暂停期间促进 mRNA衰减
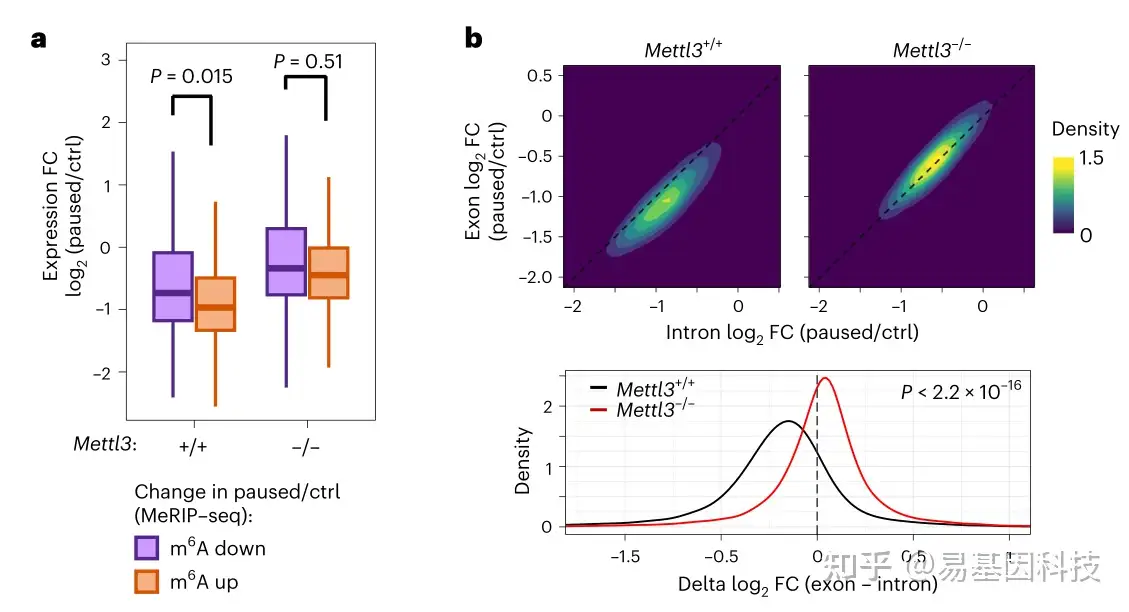
图4:Mettl3 在暂停期间促进 RNA 失稳
- 在暂停过程中m6A增加的 RNA(fold change (FC)>1.5 and adjusted P<0.05)比m6A减少的RNA明显更容易下调
- 外显子和内含子RNA-seq数据之间的表达差异(暂停/Ctrl 的 log2 FC)表明暂停后 Mettl3+/+ ES 细胞中RNA稳定性全面下降
(5)N-Myc 是受m6A调节的关键抗停滞因子
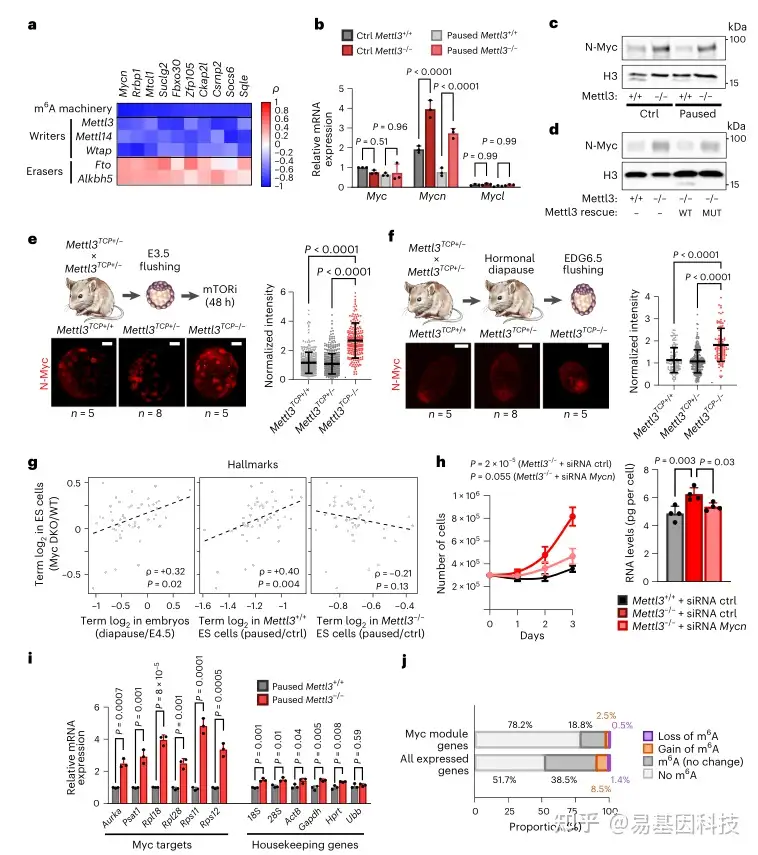
图5:转录因子N-Myc是Mettl3-/-ES细胞暂停缺陷的关键介导因子
- 为确定与体内相关的m6A靶点,根据候选基因与小鼠早期胚胎中m6A机制的斯皮尔曼相关系数对其进行排序
b-c. RT-qPCR(b)和Western 印迹(c)显示 Mettl3-/- ES 细胞中 N-Myc 表达增加
h. 敲除 Mycn 可恢复体外暂停表型,使暂停的 Mettl3-/- ES 细胞的增殖(左)和总 RNA 含量的下降(右)恢复到与暂停的 Mettl3+/+ 细胞相当的水平
- 在暂停的 Mettl3-/- ES 细胞中,EU 结合法捕获的新生 RNA 显示典型 Myc 靶基因的转录增加
研究小结:
- 本研究证明了依赖于 Mettl3 的 m6A RNA 甲基化是通过维持转录休眠来实现发育暂停的必要条件
- 依赖于Mettl3的m6A甲基化是导致暂停 ES 细胞转录组全面失稳的原因
- m6A 介导的脱稳作用导致转录扩增因子N-Myc表达下调,抑制整体新生转录
- 本研究结果揭示了哺乳动物发育暂停的分子机制,并揭示了Mettl3是基因转录组和表观转录组基因调控之间互作的关键协调者
- 本研究获得的发现以及最近开发的针对 m6A 机制的小分子抑制剂,为在发育生物学、生殖健康、再生医学和癌症领域探索 m6A RNA 甲基化的生物学特性提供了新机遇
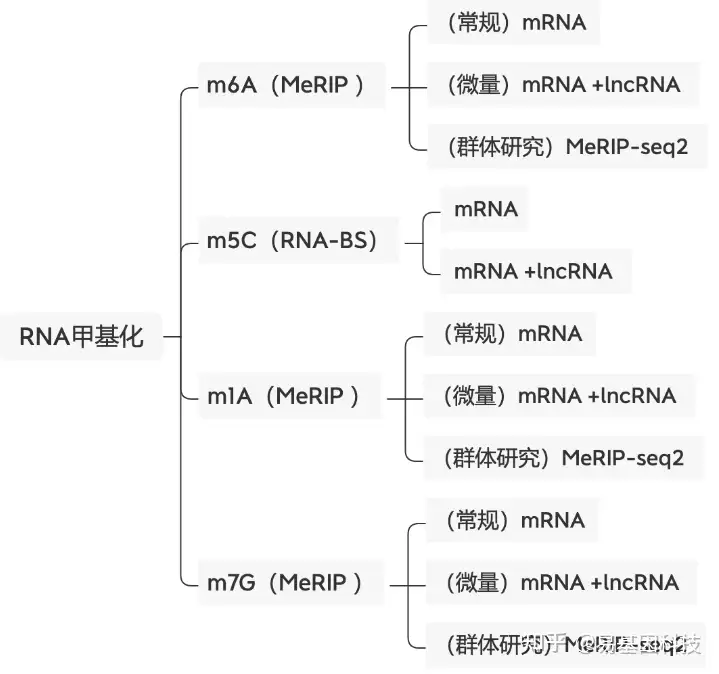
关于易基因RNA m6A甲基化测序(MeRIP-seq)技术
易基因MeRIP-seq技术利用m6A特异性抗体富集发生m6A修饰的RNA片段(包括mRNA、lncRNA等rRNA去除所有RNA),结合高通量测序,可以对RNA上的m6A修饰进行定位与定量,总RNA起始量可降低至10μg,最低仅需1μg总RNA。广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症发生与发展、药物应答等研究领域;可应用于动物、植物、细胞及组织的m6A检测。
大样本量m6A-QTL性状关联分析,传统MeRIP单个样品价格高,通常难以承担。易基因开发建立MeRIP-seq2技术,显著提成IP平行性,实现不同样本间相对定量,降低检测成本。
易基因提供适用于不同科研需求的MeRIP技术:
- m6A甲基化-常量mRNA 甲基化测序(MeRIP-seq)
- m6A甲基化-常量mRNA +lncRNA甲基化测序(lnc-MeRIP-seq)
- m6A甲基化-微量mRNA +lncRNA甲基化测序(Micro-lnc-MeRIP-seq)
- 高通量m6A甲基化-常量mRNA甲基化测序(MeRIP-seq2)
技术优势:
- 起始量低:样本起始量可降低至10-20μg,最低仅需1μg总RNA;
- 转录组范围内:可以同时检测mRNA和lncRNA;
- 样本要求:可用于动物、植物、细胞及组织的m6A检测;
- 重复性高:IP富集重复性高,最大化降低抗体富集偏差;
- 应用范围广:广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症的发生与发展、药物应答等研究领域。
研究方向:
m6A甲基化目前主要运用在分子机制的理论性研究
- 疾病发生发展:肿瘤、代谢疾病(如肥胖/糖尿病)、神经和精神疾病(如阿尔兹海默症/抑郁症)、炎症…
- 发育和分化:早期胚胎发育、个体/组织/器官生长发育、干细胞分化与命运决定、衰老
- 环境暴露与响应:污染、抗逆、生活方式
关于m6A甲基化研究思路
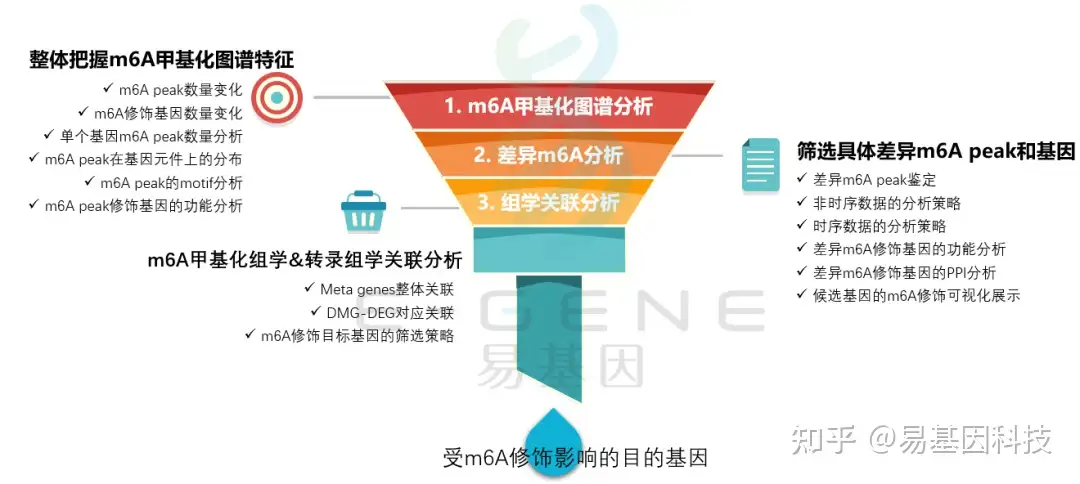
(1)整体把握m6A甲基化图谱特征:m6A peak数量变化、m6A修饰基因数量变化、单个基因m6A peak数量分析、m6A peak在基因元件上的分布、m6A peak的motif分析、m6A peak修饰基因的功能分析
(2)筛选具体差异m6A peak和基因:差异m6A peak鉴定、非时序数据的分析策略、时序数据的分析策略、差异m6A修饰基因的功能分析、差异m6A修饰基因的PPI分析、候选基因的m6A修饰可视化展示
(3)m6A甲基化组学&转录组学关联分析:Meta genes整体关联、DMG-DEG对应关联、m6A修饰目标基因的筛选策略
(4)进一步验证或后期试验
关于易基因染色质免疫共沉淀测序 (ChIP-seq)
染色质免疫共沉淀(Chromatin Immunoprecipitation,ChIP),是研究体内蛋白质与DNA相互作用的经典方法。将ChIP与高通量测序技术相结合的ChIP-Seq技术,可在全基因组范围对特定蛋白的DNA结合位点进行高效而准确的筛选与鉴定,为研究的深入开展打下基础。
DNA与蛋白质的相互作用与基因的转录、染色质的空间构型和构象密切相关。运用组蛋白特定修饰的特异性抗体或DNA结合蛋白或转录因子特异性抗体富集与其结合的DNA片段,并进行纯化和文库构建,然后进行高通量测序,通过将获得的数据与参考基因组精确比对,研究人员可获得全基因组范围内某种修饰类型的特定组蛋白或转录因子与基因组DNA序列之间的关系,也可对多个样品进行差异比较。
应用方向:
ChIP 用来在空间上和时间上不同蛋白沿基因或基因组定位
- 转录因子和辅因子结合作用
- 复制因子和 DNA 修复蛋白
- 组蛋白修饰和变异组蛋白
技术优势:
- 物种范围广:细胞、动物组织、植物组织、细菌微生物多物种富集经验;
- 微量建库:只需5ng以上免疫沉淀后的DNA,即可展开测序分析;
- 方案灵活:根据不同的项目需求,选择不同的组蛋白修饰特异性抗体。
技术路线:
易基因提供全面的RNA甲基化研究及DNA与蛋白互作研究解决方案,详询易基因:0755-28317900.
参考文献:
Collignon E, Cho B, Furlan G, Fothergill-Robinson J, Martin SB, McClymont SA, Ross RL, Limbach PA, Ramalho-Santos M. m6A RNA methylation orchestrates transcriptional dormancy during paused pluripotency. Nat Cell Biol. 2023 Sep;25(9):1279-1289.
相关阅读:
科研进展:m⁶A-seq等揭示RBM33参与调控m⁶A去甲基化酶ALKBH5活性及其底物选择性
肿瘤研究 | MeRIP-seq等揭示组蛋白乙酰化和m⁶A修饰在眼部黑色素瘤发生中的互作调控
植物抗逆:MeRIP-seq等揭示mRNA m⁶A甲基化调控拟南芥的抗寒性分子机制
标签:seq,m6A,MeRIP,Mettl3,甲基化,转录,暂停,RNA From: https://www.cnblogs.com/E-GENE/p/17831255.html