大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
此前,我们分享了染色质免疫共沉淀测序(ChIP-seq)的数据挖掘思路,进而筛选出TF结合/组蛋白修饰的目标区域和候选靶基因。
做完ChIP-seq测序后,如果需要对分析结果中感兴趣的内容进行后期验证,则需要进行下游实验设计。ChIP-seq的进一步验证或后期试验包括以下5个方面:
- 简单验证
- 转录因子或组蛋白修饰添加基因的干扰实验(非靶向),验证是否影响目标基因表达和细胞功能
- 靶向目标区域的TF结合/组蛋白修饰干扰实验,检测其影响下游靶基因的表达
- 引入突变后,荧光素酶实验验证转录因子结合的motif,并证明结合后直接调控靶基因的表达
- 超级增强子
一、简单验证
(1)目标基区域转录因子结合/组蛋白修饰的验证:CHIP-qPCR
(2)检测目标基因的mRNA表达水平:RT-qPCR
(3)检测目标基因蛋白质表达水平:Western blot
二、转录因子或组蛋白修饰添加基因的干扰实验(非靶向),验证是否影响目标基因表达和细胞功能
(1)转录因子或组蛋白修饰添加基因的干扰:基因的突变/敲降/敲除/过表达、相关蛋白的抑制剂
(2)检测TF结合/组蛋白修饰的整体变化:CHIP-seq
(3)检测目标区域的TF结合/组蛋白修饰的变化:CHIP-qPCR
(4)检测下游靶基因的mRNA水平:RT-qPCR
(5)检测下游靶基因蛋白质水平:Western blot
(6)检测细胞功能/表型变化
三、靶向目标区域的TF结合/组蛋白修饰干扰实验,检测其影响下游靶基因的表达
(1)目的基因结合/修饰干扰细胞系的构建:荧光素酶活性分析实验(Luciferase activity assay)、CRISPER-CAS9靶向目标区域引入突变/修饰
- 确定并验证与转录因子结合的motif
- 验证与该motif结合之后是否能影响靶基因表达
- 不同区域引入突变以确定关键结合位点
(2)检测目标区域的TF结合/组蛋白修饰变化:CHIP-qPCR
(3)检测荧光素酶报告基因的mRNA表达水平:RT-qPCR
(4)检测目标基因蛋白质表达水平:Western blot
(5)检测细胞功能受到的影响:免疫荧光显微观察、功能标志物测定……
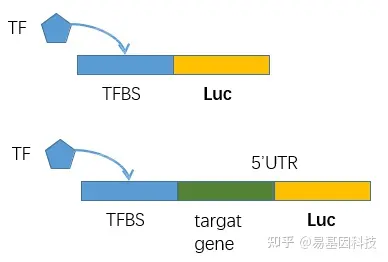
用于验证TF结合并调控下游基因的荧光素酶报告系统
四、引入突变后,荧光素酶实验验证转录因子结合的motif,并证明结合后直接调控靶基因的表达
top3的motif中,只有MEME-2能够激活荧光素酶基因表达,表明FUS1转录因子结合的是MEME-2 motif
在靶基因3’UTR插入荧光素酶基因,只有FUS1组能够激活荧光素酶基因的表达,表明只有FUS1组具有转录因子活性
引入S486E突变影响到该转录因子对MEME-2的结合,也最终影响到靶基因的表达
五、超级增强子
(1)根据通用型转录辅因子Med1在CHIP-seq实验中富集程度的高低,可以将增强子分为以下两类:
typical enhancers(TE):长度为几百bp
super enhancers(SE):长度几千bp
(2)超级增强子的预测建立在增强子的基础上,可以看做增强子富集的区域。
(3)相比增强子,超级增强子区域具有更高的转录因子的密度,能够让转录效率提高达几百倍。
(4)H3K27ac是活性增强子的标志,可以通过H3K27ac CHIP-seq鉴定TE和SE。
CHIP-seq实验成功的关键问题
(1)抗体质量
ChIP-seq是基于抗体的免疫沉淀实验,因此它的数据质量好坏直接取决于抗体的质量和特异性。
另外,针对同一蛋白的不同抗体,可能会识别不同的表位(尤其是单克隆抗体)。因此建议针对同一感兴趣蛋白测试不同的抗体,通过Western blot检测knock-down前后的差异帮助选择。
(2)测序数据量
为了捕获所有真实的结合位点,而我们看不见摸不着,只能通过测序的reads去计算来帮助判断,因此测序reads的数量是一个决定因素。
需要多少reads呢?
这个取决于基因组的大小和感兴趣因子的结合方式(sharp regions for TFs and broad regions for histone marks)。哺乳动物中,鉴定TFs至少要满足10-20M,broad histone marks至少要10-45M,input对照要和ChIP样本保持同样测序深度。reads数量还取决于抗体质量和免疫沉淀的效率。信噪比越高,需要的reads数可以适当减少。
(3)生物学重复
样本重复可以看到实验设计的好坏,选择相关性高的样本进行后续分析
推荐三个生物重复,但两个现在也能接受(最粗略的实验设计就是:每个ChIP样本2个重复,input只有一个没有重复)
如果样本间的本质差异越大,越需要设置重复,例如从不同人取的样本。
关于易基因染色质免疫共沉淀测序 (ChIP-seq)
染色质免疫共沉淀(Chromatin Immunoprecipitation,ChIP),是研究体内蛋白质与DNA相互作用的经典方法。将ChIP与高通量测序技术相结合的ChIP-Seq技术,可在全基因组范围对特定蛋白的DNA结合位点进行高效而准确的筛选与鉴定,为研究的深入开展打下基础。
DNA与蛋白质的相互作用与基因的转录、染色质的空间构型和构象密切相关。运用组蛋白特定修饰的特异性抗体或DNA结合蛋白或转录因子特异性抗体富集与其结合的DNA片段,并进行纯化和文库构建,然后进行高通量测序,通过将获得的数据与参考基因组精确比对,研究人员可获得全基因组范围内某种修饰类型的特定组蛋白或转录因子与基因组DNA序列之间的关系,也可对多个样品进行差异比较。
应用方向:
ChIP 用来在空间上和时间上不同蛋白沿基因或基因组定位
- 转录因子和辅因子结合作用
- 复制因子和 DNA 修复蛋白
- 组蛋白修饰和变异组蛋白
技术优势:
- 物种范围广:细胞、动物组织、植物组织、细菌微生物多物种富集经验;
- 微量建库:只需5ng以上免疫沉淀后的DNA,即可展开测序分析;
- 方案灵活:根据不同的项目需求,选择不同的组蛋白修饰特异性抗体。
技术路线:
有ChIP-seq测序或组学研究需要的老师可联系易基因。
相关阅读:
干货系列:高通量测序后的下游实验验证方法——m6A RNA甲基化篇
标签:seq,测序,ChIP,组蛋白,基因,转录,修饰,高通量 From: https://www.cnblogs.com/E-GENE/p/17219012.html