大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
自闭症谱系障碍(Autism spectrum disorder,ASD)是一种神经发育障碍,以社交沟通障碍和刻板行为为主要特征。许多研究证明,妊娠期暴露于环境毒素会导致儿童中ASD患病率快速增长。1-硝基芘(1-Nitropyrene,1-NP)一种主要存在于柴油排放颗粒(DEPs)和烹饪排放中的特征性硝基多环芳烃(nitro-PAH)。早期报告显示,妊娠晚期暴露于1-NP(10 µg/kg)与子代青少年学习力和记忆力下降有关。整个妊娠期暴露于1-NP(10、100 µg/kg)引起了子代成年阶段的焦虑样行为。尽管这些神经系统疾病与1-NP暴露有关,但目前尚不清楚母亲1-NP暴露是否在子代中诱导自闭症样行为。
越来越多证据表明内侧前额叶皮层(medial prefrontal cortex,mPFC)中的中间神经元在社交沟通调节中发挥关键作用,中间神经元迁移迟缓导致小鼠出现自闭症样行为。一些研究表明,羟甲基化修饰参与胎盘滋养层细胞和神经干细胞迁移。那么产前1-NP暴露是否会通过抑制与中间神经元迁移相关基因的羟甲基化修饰来抑制中间神经元迁移呢?
2024年5月16日,安徽医科大学硕士研究生赵婷为第一作者、合肥工业大学黄程青博士和安徽医科大学张医浩副教授为共同第一作者,安徽医科大学公共卫生学院徐德祥教授为通讯作者、王博副教授为共同通讯在《Advanced Science》(Adv Sci)期刊发表题为“Prenatal 1-Nitropyrene Exposure Causes Autism-Like Behavior Partially by Altering DNA Hydroxymethylation in Developing Brain”的研究论文,研究通过APOBEC-coupled epigenetic sequencing(ACE-seq)和RNA-seq多组学分析揭示了母体孕期1-NP暴露会通过改变发育大脑中与中间神经元迁移相关的DNA羟甲基化调控下游基因表达,进而介导子代出现自闭症样行为表型。此外,研究还表明补充α-酮戊二酸(α-KG,TET酶的辅因子),可以逆转1-NP诱导的中间神经元迁移相关基因特定位点的低羟甲基化,缓解中间神经元迁移延迟并改善由1-NP引起的自闭症。

标题:Prenatal 1-Nitropyrene Exposure Causes Autism-Like Behavior Partially by Altering DNA Hydroxymethylation in Developing Brain(产前1-硝基芘暴露通过脑发育过程中DNA羟甲基化变化诱导子代自闭症样行为)
期刊:Advanced Science
影响因子:IF 14.3 / Q1
技术平台:ACE-seq(易基因优势技术)、RNA-seq、行为评估、细胞功能分析等
研究摘要:
本研究旨在研究产前暴露于1-硝基芘(1-NP)对小鼠模型中自闭症样行为的影响。三室社交互动测试结果表明,产前1-NP暴露在断奶期间引起自闭症样行为。膜片钳技术显示,在1-NP暴露的断奶幼崽内侧前额叶皮层中的抑制性突触传递减少。免疫荧光显示,产前1-NP暴露减少了胎儿和断奶幼崽前额叶中谷氨酸脱羧酶67(GAD67)阳性的中间神经元数量。此外,产前1-NP暴露导致GAD67阳性中间神经元迁移延迟,并下调胎儿前脑与中间神经元迁移相关的基因,如Nrg1、Erbb4和Sema3F。从机制上讲,产前1-NP暴露通过抑制胎儿前脑中的TET活性,以诱导中间神经元迁移相关基因的羟甲基化降低。补充α-KG(TET酶辅因子)可以逆转1-NP诱导的中间神经元迁移相关基因特定位点的低羟甲基化。实验结果表明,α-KG补充剂缓解了胎儿前脑中1-NP诱导的中间神经元迁移延迟;母体α-KG补充剂改善了断奶子代中1-NP诱导的自闭症样行为。总之,产前1-NP暴露可以通过发育中大脑中间神经元迁移相关基因的DNA羟甲基化变化,而引起自闭症样行为。
实验设计:
30只怀孕小鼠随机分为3组,分别给予不同剂量的1-NP(0、10、100μg/kg);后续实验怀孕小鼠分为不同的处理组:对照组、1-NP暴露组、α-KG补充组以及1-NP+α-KG联合组。产前在指定时间点收集胎儿前脑样本;产后在指定时间点收集子代前额叶皮质(mPFC)样本。用于后续的行为评估、DNA羟甲基化检测(ACE-seq)、TET酶活性检测、α-KG水平检测、RNA测序(RNA-seq)与RT-PCR验证、细胞功能分析等实验。
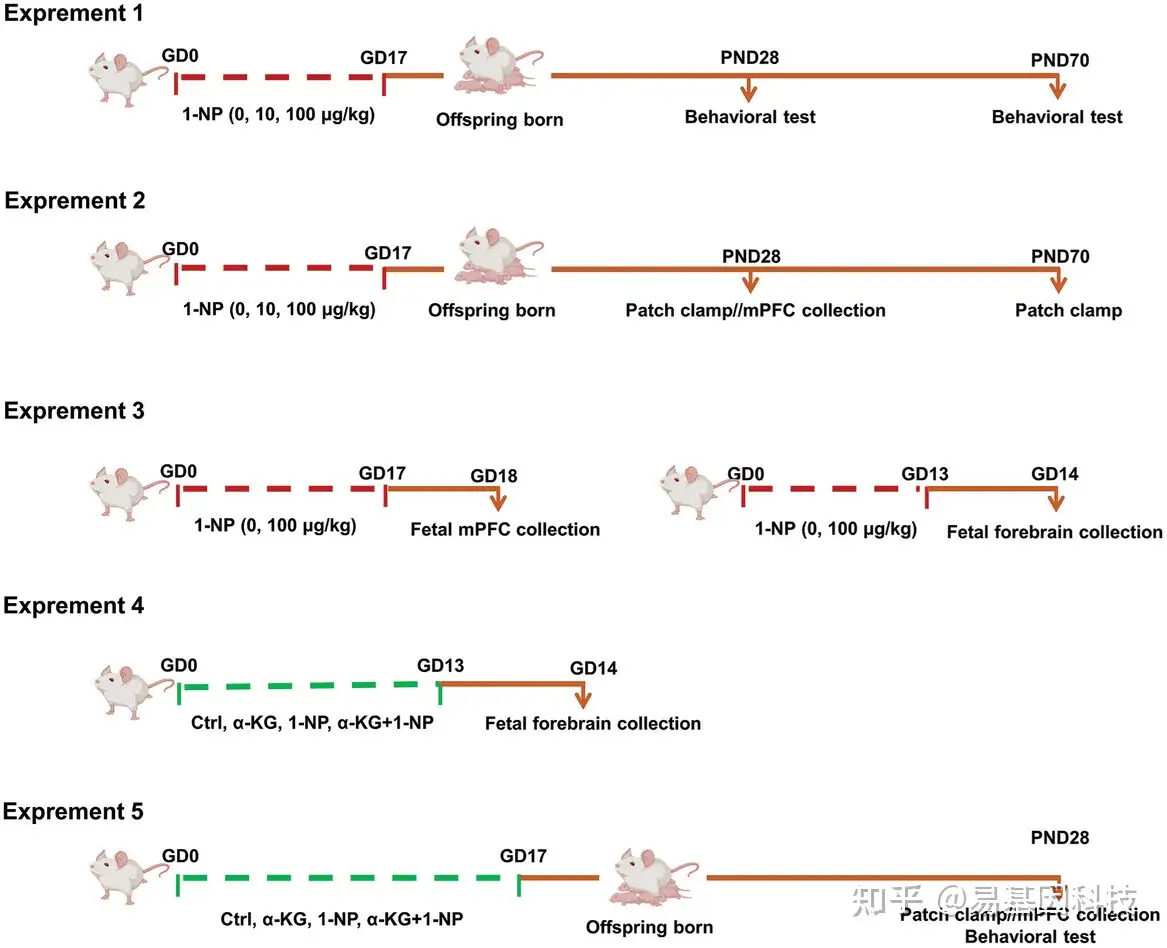
图1:动物和处理的实验方案
结果图形:
(1)母体 1-NP 暴露对子代自闭症样行为的影响
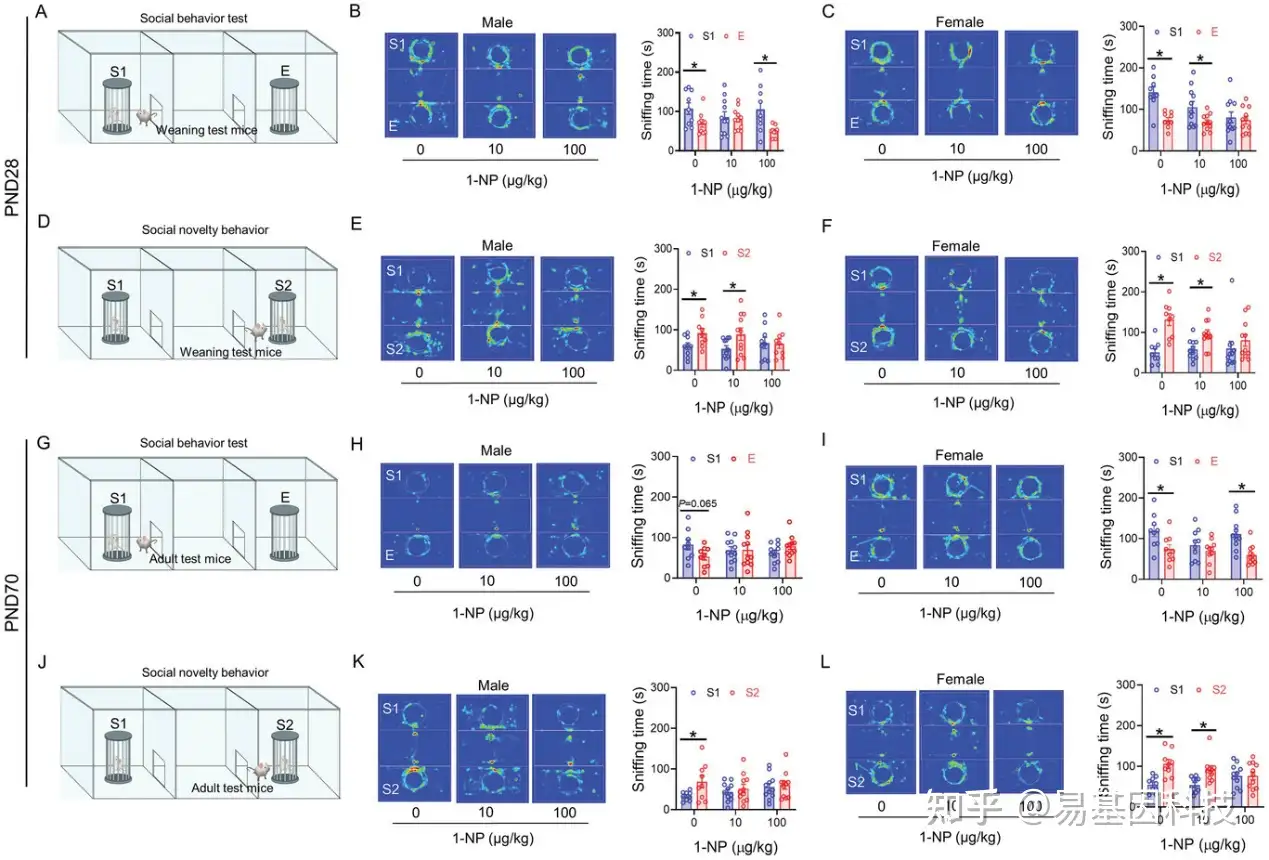
图2:母体1-NP暴露对断奶子代自闭症样行为的影响。30只怀孕小鼠从妊娠第0天(GD0)到第17天(GD17)每天口服接受不同剂量的1-NP(0,10, 100 µg/kg)。所有怀孕的小鼠都自然分娩。
A–F) 使用三室社交互动测试来评估断奶子代(PND28)的自闭症样行为。
G–L) 使用三室社交互动测试来评估成年子代(PND70)的自闭症样行为。
(2)母体1-NP暴露对子代mPFC中微小抑制性后神经突触电流(miniature inhibitory postsynaptic current,mIPSC)的影响
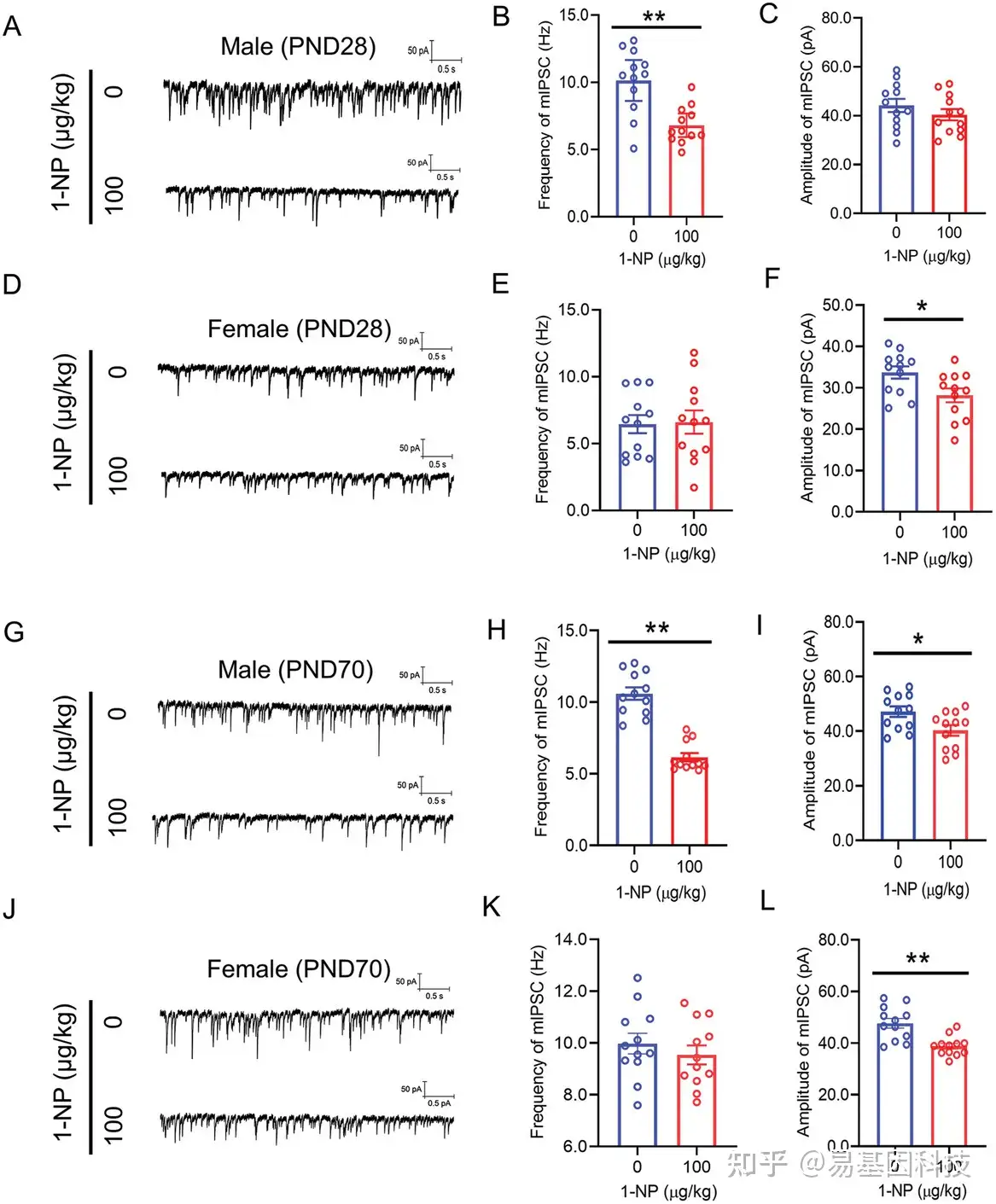
图3:母体1-NP暴露对子代mIPSC的影响。
A–F) 对断奶子代(PND28)的兴奋性神经元进行膜片钳实验,以检测前额叶皮层(mPFC)中的微小抑制性突触后电流(mIPSC)。
G–L) 对成年子代(PND70)的兴奋性神经元进行膜片钳实验,以测量mPFC中的mIPSC。每组样本量(N)为3只小鼠的12个兴奋性神经元。
(3)孕期母体1-NP暴露对断奶子代mPFC中GAD67+中间神经元的影响
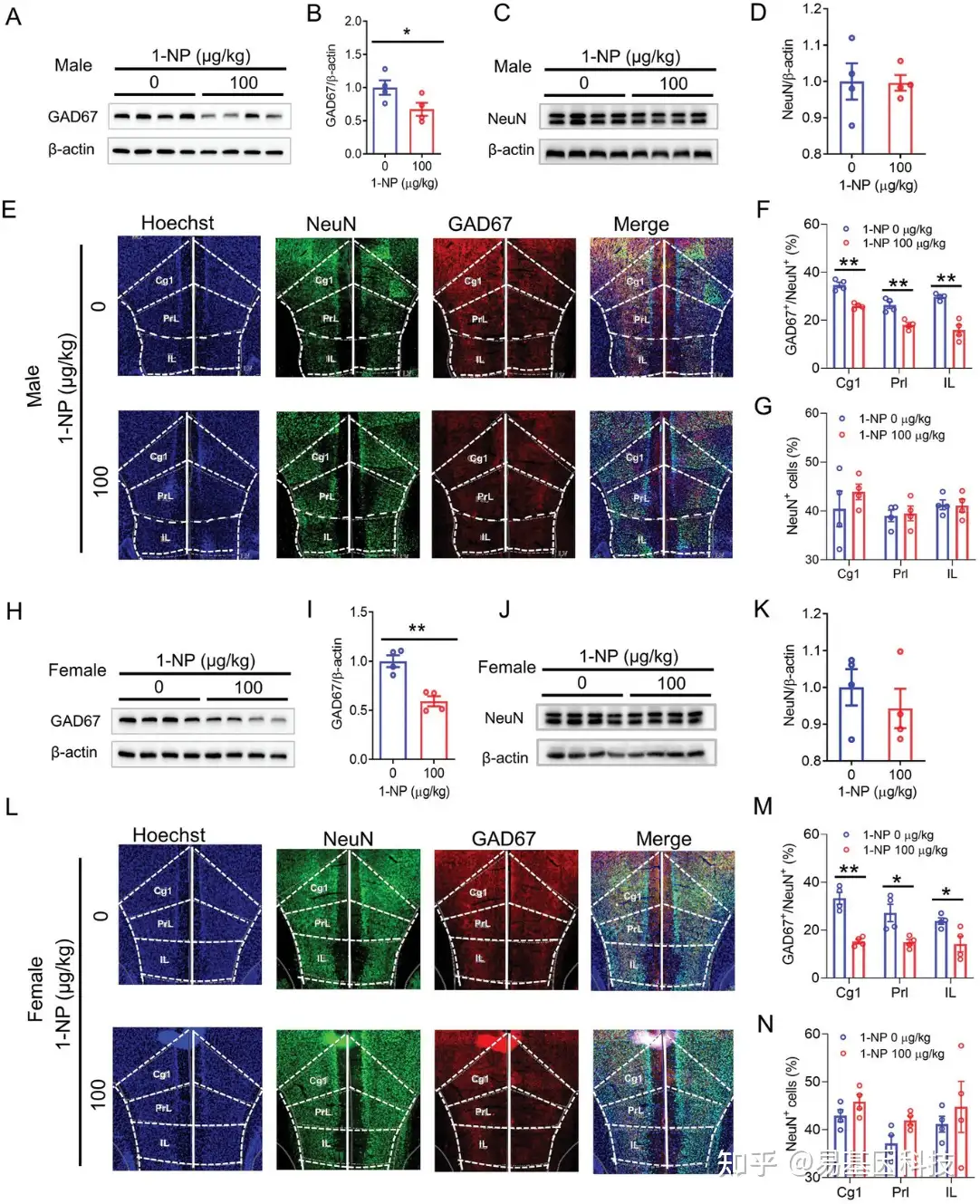
图4:母体1-NP暴露对断奶子代GAD67中间神经元的影响。
A–G) 雄性子代在PND28被安乐死,并且采集其前额叶皮层(mPFC)。
A-B. Western blot检测GAD67。
C-D. Western blot检测NeuN。
E. 免疫荧光(IF)分析mPFC各个亚区的GAD67+和NeuN+神经元。
F. mPFC各个亚区中GAD67+与NeuN+神经元的比例。
G. mPFC各个亚区中NeuN+神经元的百分比。
H–N) 雌性子代在PND28被安乐死,并且收集其mPFC。
H-I. Western blot检测GAD67。
J-K. Western blot检测NeuN。
L. 免疫荧光分析mPFC各个亚区的GAD67+和NeuN+神经元。
M. mPFC各个亚区中GAD67+与NeuN+神经元的比例。
N. mPFC各个亚区中NeuN+神经元的百分比。
Cg1:cingulate cortex, area 1;PrL:prelimbic cortex;IL:infralimbic cortex。
(4)妊娠期1-NP 暴露对胎儿前脑中间神经元迁移的影响
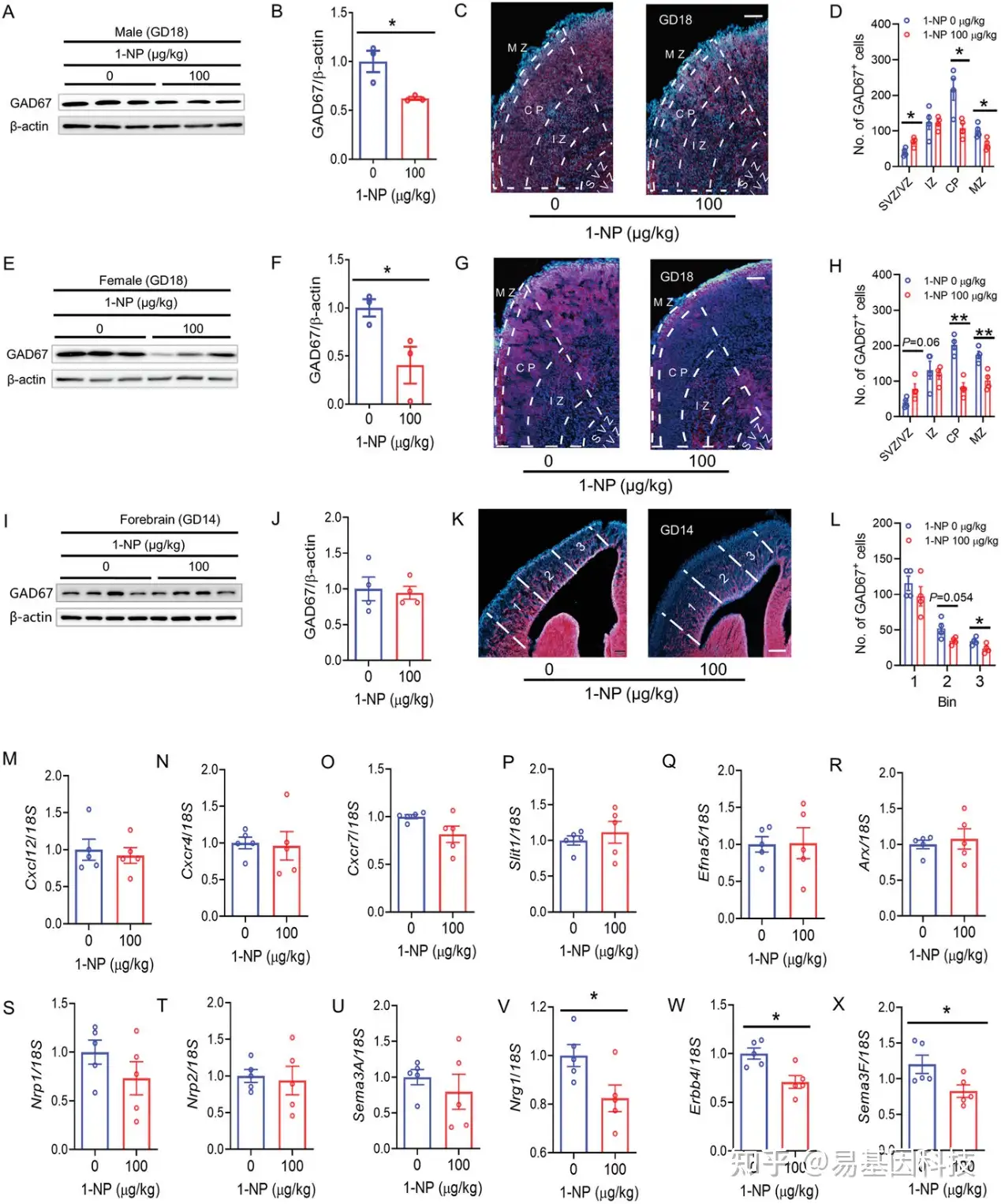
图5:妊娠期1-NP暴露对胎儿大脑中间神经元迁移的影响
(5)妊娠期1-NP暴露对胎儿前脑神经元迁移相关基因羟甲基化的影响
在妊娠期第14天(GD14)的胎儿前脑中,分析了妊娠期1-NP暴露对中间神经元迁移相关基因中5-羟甲基胞嘧啶(5hmC)含量的影响。Nrg1、Erbb4和Sema3F基因的甲基化位点序列(图6A),尽管Nrg1和Erbb4基因中富含CpG片段的5hmC水平在两组间没有差异,但在1-NP暴露的胎儿中,Sema3F基因的一个富集CpG片段的5hmC水平有所降低(图6B)。随后检测了Nrg1、Erbb4和Sema3F基因CpG位点的5hmC含量(图6C),在1-NP组胎儿前脑中,Nrg1基因的CpG位点(chr1:32009246)的5hmC含量减少。在1-NP组胎儿前脑中,Erbb4基因的两个CpG位点(chr8: 69107743和69107866)的5hmC含量减少。而在1-NP组胎儿中,Sema3F基因的三个CpG位点(chr9: 107709269、107709348和107710238)的5hmC水平降低。在胎儿前脑中分析了三种DNA去甲基化酶TET1、TET2和TET3的活性。尽管1-NP并未影响TET1、TET2和TET3的表达(图6D–F),但在1-NP组胎儿的前脑中,TETs酶的活性降低(图6G)。
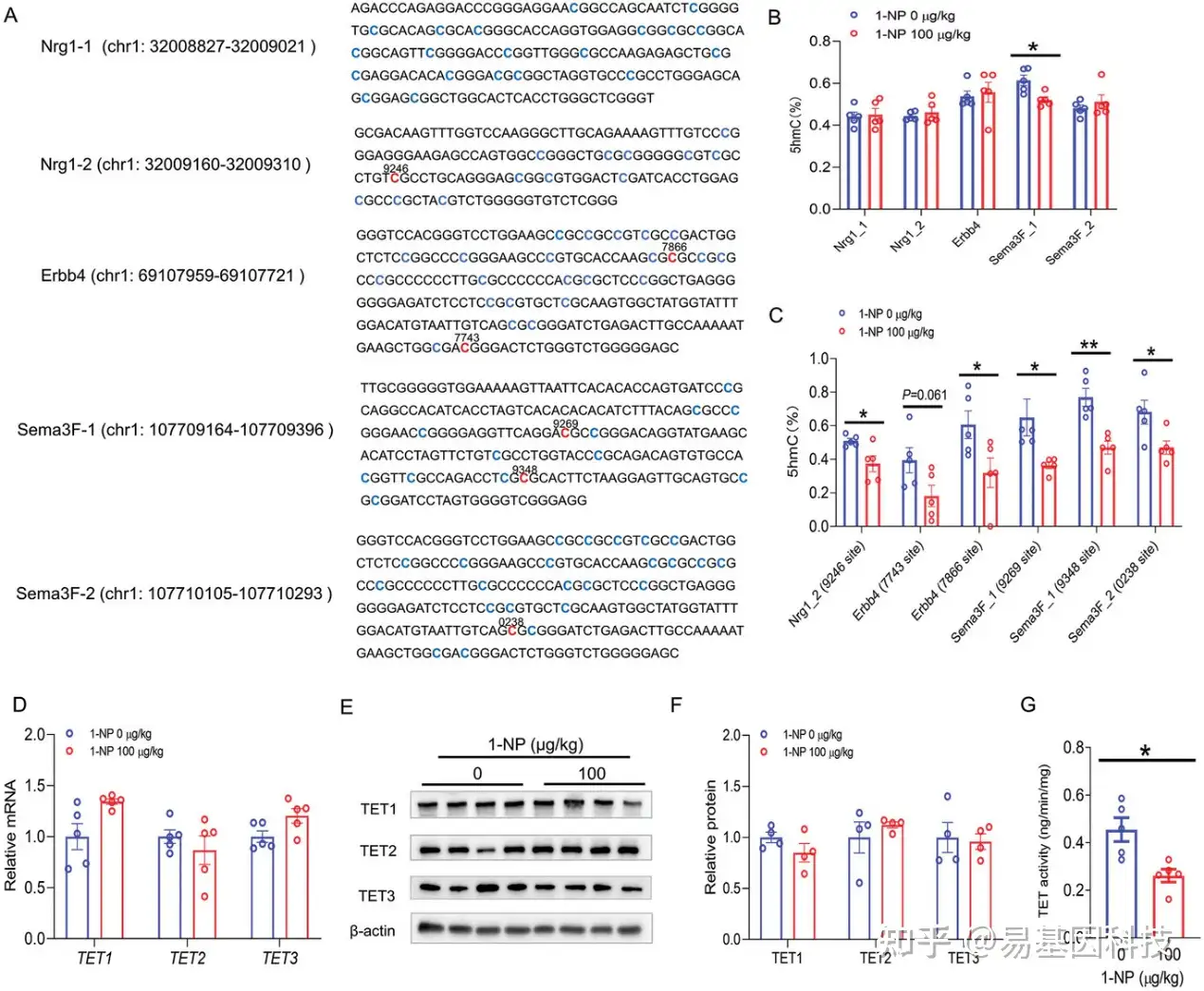
图6:妊娠1-NP暴露对胎儿前脑中间神经元迁移相关基因羟甲基化的影响。
(6)妊娠期1-NP暴露对胎儿前脑线粒体功能的影响
为研究1-NP暴露导致胎儿前脑中与中间神经元迁移相关基因的羟甲基化变化以及抑制TET酶活性的原因,研究对妊娠第14天(GD14)的胎儿前脑进行转录组分析。KEGG和GO分析发现,1-NP导致前脑的线粒体相关代谢功能出现障碍,例如烟酸/烟酰胺代谢、类固醇生物合成和长链脂肪酸代谢(图7A、B)。基于KEGG的基因集富集分析(GSEA)显示,在1-NP暴露的胎儿前脑中,氧化磷酸化通路呈负向富集(图7C)。基于GO的GSEA显示,在1-NP暴露的胎儿前脑中线粒体电子传递链和氧化磷酸化通路呈负向富集(图7D,E)。基于Reactome的GSEA显示,三羧酸(TCA)循环和呼吸电子传递在1-NP暴露的胎儿前脑中呈负向富集(图7F)。尽管线粒体面积没有差异,但在1-NP暴露的胎儿前脑中,中间神经元起源地神经节隆起的线粒体嵴结构消失(图7G–I)。琥珀酸脱氢酶(SDH)B和vATP5A(两种与氧化磷酸化相关的蛋白)在1-NP诱导的胎儿前脑中下调(图7J–L)。最后线粒体α-酮戊二酸(α-KG)合成的关键酶IDH2和TET酶的辅因子α-KG,在1-NP组的胎儿前脑中减少(图7M–O)。
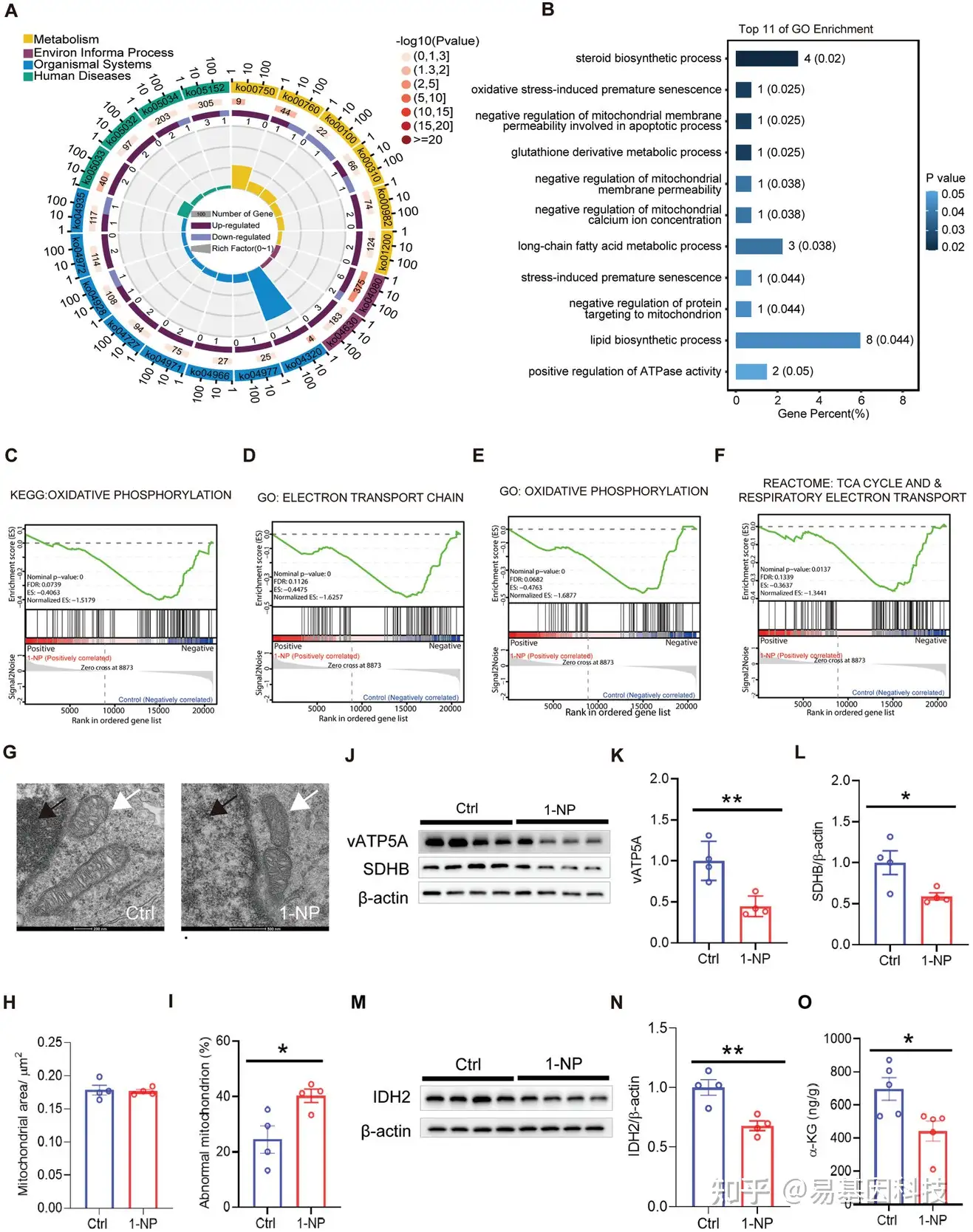
图7:妊娠期1-NP暴露对胎儿前脑线粒体功能的影响。
(7)补充α-KG对胎儿前脑中1-NP诱发的神经元迁移相关基因低羟甲基化的影响
补充α-KG对1-NP引起的中间神经元迁移相关基因低羟甲基化的影响(图8A-F)。正如预期,妊娠期间补充α-KG抑制了1-NP引起的Nrg1基因中CpG位点(chr1: 32009246)的5hmC减少(图8A)。此外,妊娠期间补充α-KG预防了1-NP引起的Sema3F基因一个CpG位点(chr9:107710238)的5hmC减少(图8F)。补充α-KG可以保护1-NP诱导的Erbb4或其他Sema3F基因CpG位点的5hmC减少趋势(图8B–E)。分析α-KG对1-NP引起的中间神经元迁移相关基因表达减少的影响(图8G–I),结果表明,妊娠期间补充α-KG缓解了1-NP在胎儿前脑中引起的Sema3F、Nrg1和Erbb4减少(图8G–I)。α-KG补充对1-NP引起的神经元间迁移抑制的影响(图8J、K)结果表明,妊娠期补充 α-KG 逆转了 1-NP 导致前脑皮层中端和远端 GAD67 中间神经元减少。
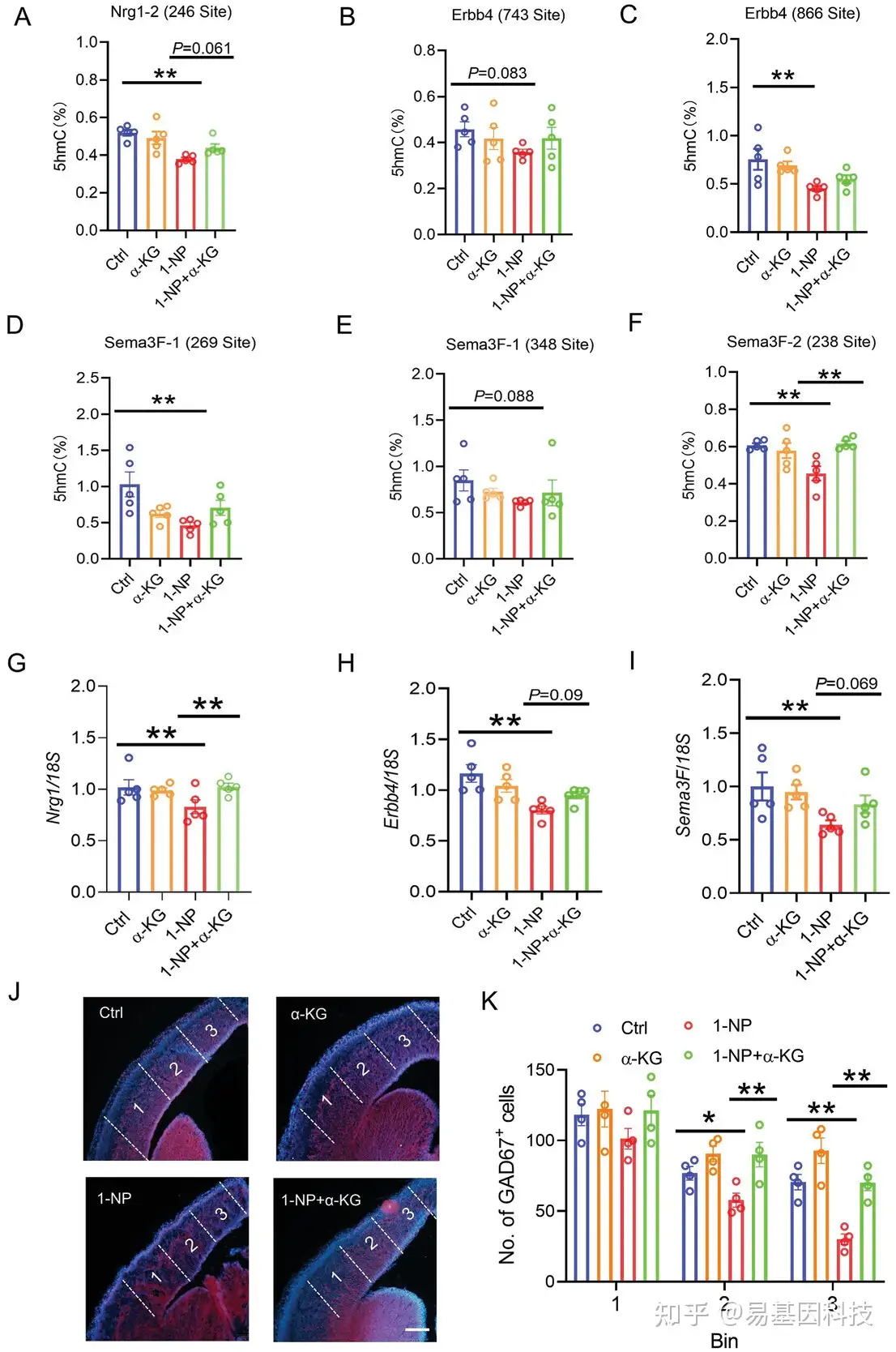
图8:补充α-KG对1-NP诱发的胎儿前脑中间神经元迁移相关基因的低羟基甲基化和中间神经元迁移抑制的影响
(8)补充α-KG对1-NP诱导的中间神经元迁移抑制的影响
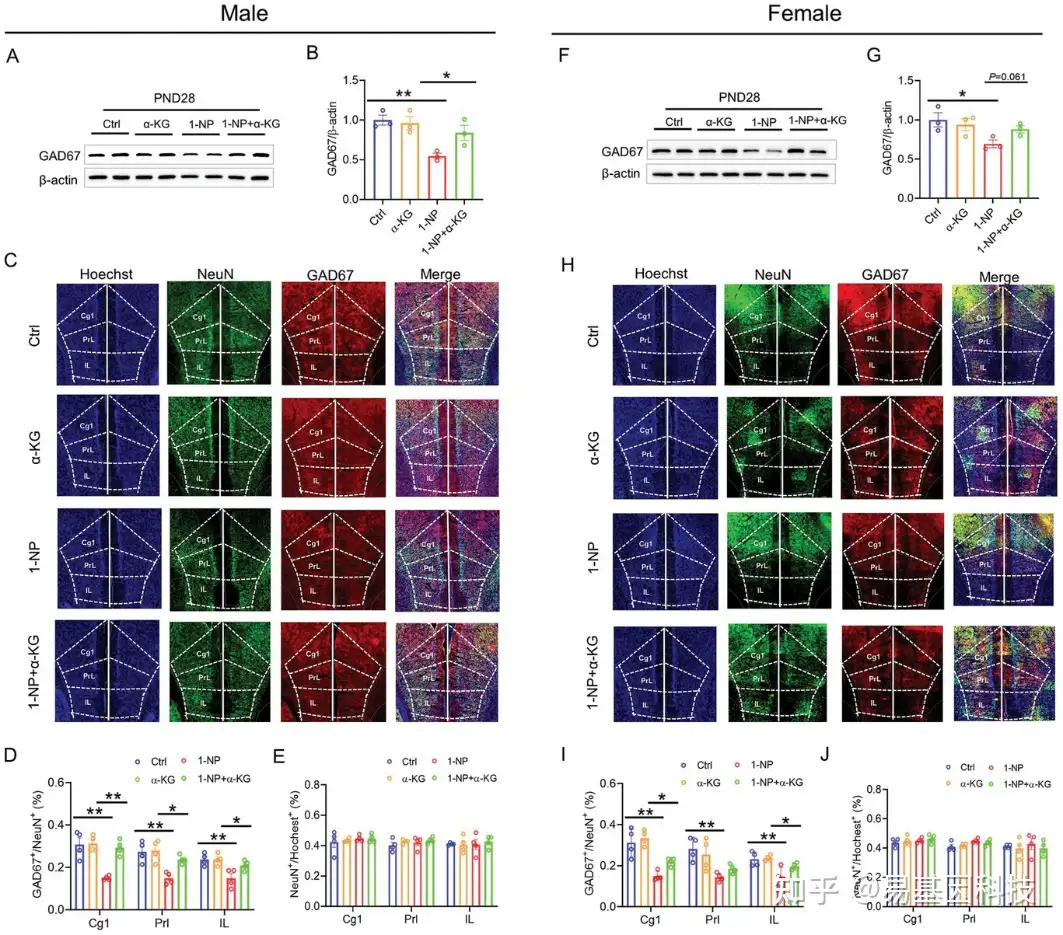
图9:妊娠期补充 -KG对断奶子代中间神经元的影响
(9)补充α-KG对1-NP诱导的子代mIPSC传递障碍和自闭症样行为的影响
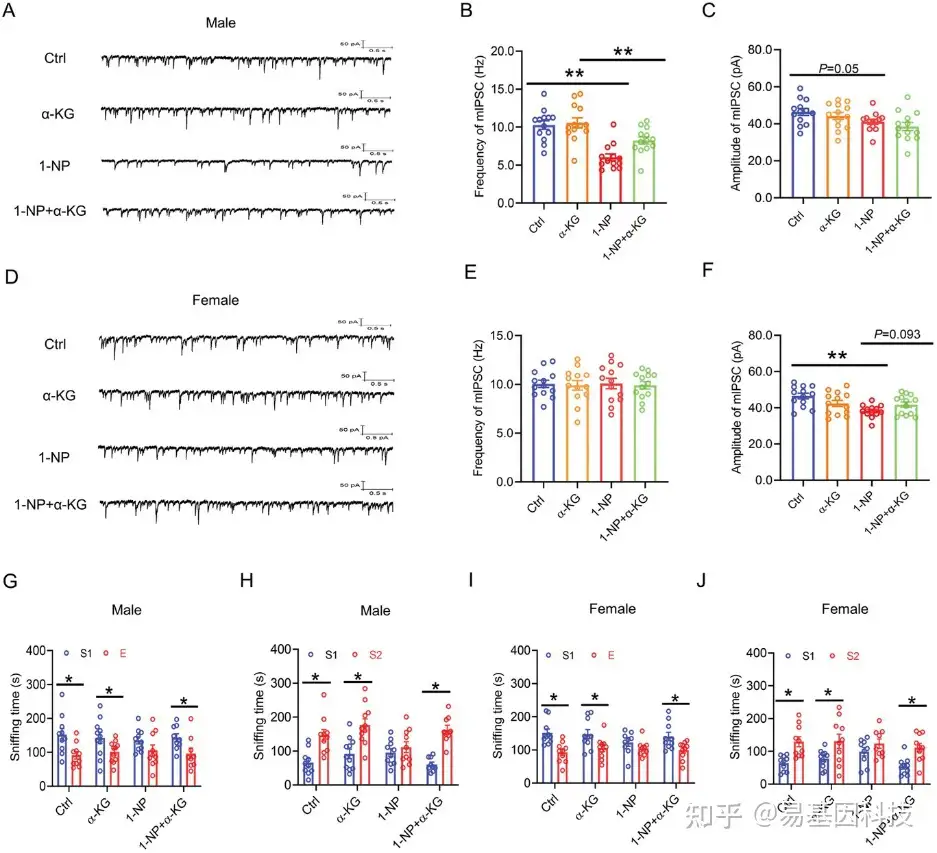
图10:妊娠期补充 -KG对1-NP诱导mIPSC传递障碍和自闭症样行为的影响
易小结
本研究利用小鼠模型进行实验,将怀孕小鼠分为不同剂量的1-NP暴露组。通过三室测试评估幼崽的ASD样行为;使用膜片钳技术检测小鼠大脑前额叶皮层的抑制性突触传递;通过免疫荧光技术检测特定脑区的神经元数量和迁移;利用ACE-seq和RNA-seq检测与神经元迁移相关的基因表达和DNA羟甲基化水平;最后通过补充α-酮戊二酸( -KG)来研究其对1-NP诱导的效应的逆转作用。
研究结果揭示了产前1-NP暴露导致断奶期小鼠出现ASD样行为。1-NP暴露减少了小鼠大脑前额叶皮层中抑制性突触传递;减少了胎儿和断奶幼崽前额叶中的谷氨酸脱羧酶67(GAD67)阳性神经元数量;延缓了GAD67阳性神经元的迁移,并下调了与神经元迁移相关的基因表达;通过抑制TET酶活性降低了特定基因的羟甲基化水平。补充 -KG能够逆转1-NP诱导的羟甲基化降低,并改善神经元迁移延迟。母体补充 -KG能够改善1-NP诱导的幼崽ASD样行为。
总之,本研究结果表明,产前1-NP暴露通过改变发育中大脑内神经元迁移相关基因的DNA羟甲基化,部分导致了ASD样行为。 -KG补充可能是一种用于减轻环境毒素引起的神经发育障碍的潜在干预措施。本研究提供了关于环境污染物如何可能影响神经发育和行为的新见解,并为预防和治疗相关的神经发育障碍提供了可能的策略。
关于ACE-seq羟甲基化测序技术
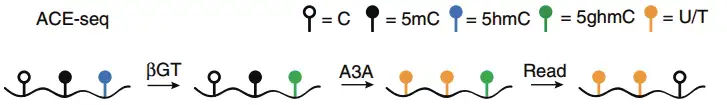
APOBEC-coupled epigenetic sequencing(ACE-seq)技术是一种全新的鉴定5hmC的方法。DNA脱氨酶APOBEC3A(A3A)能够特异地脱去C及5mC的氨基使其变为U,而5hmC则因为不被该酶识别,测序时仍被识别为C。该技术利用该酶的这种特性,特异性地检测基因组上发生的5hmC修饰。ACE-seq原理示意如下:
(1)利用β-葡糖基转移酶(βGT)将5hmC加上葡糖基,转变成5ghmC,5ghmC不会被A3A酶脱氨基。
(2)利用A3A酶特异去除C和5mC的氨基,使其转变成U,而5hmC保持为C,从而将5hmC和C/5mC区分开来。
ACE-Seq具有以下优势:
- 检测范围为全基因组。可以得到基因组上大部分C位点的羟甲基化水平。
- 单碱基分辨率。能够检测单个C碱基的羟甲基化水平,精确度高。
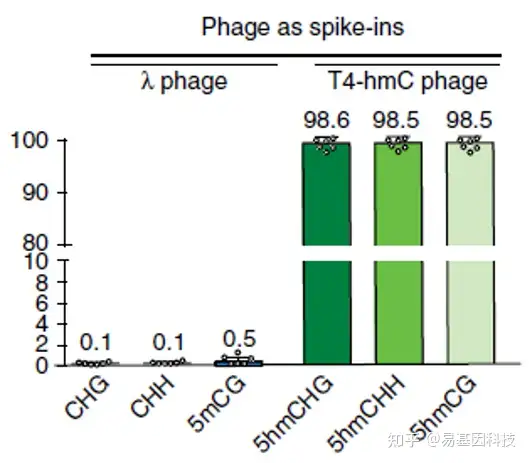
- 低起始量。ACE-Seq利用脱氨酶实现5hmC与C及5mC的区分,反应条件温和,不破坏基因组,大大减少基因组DNA的损失,因此起始DNA量比常规的oxBS技术降低100倍。
- 高准确性。绝大部分甲基化修饰的C都被转化成U,而绝大部分经过糖基化修饰的5hmC(5ghmC)则保持为C,表明该技术具有充分的可靠性。
- 经济性。仅需一个文库解决问题,羟甲基化研究成本大大降低。
参考文献:
Zhao T, Huang CQ, Zhang YH, Zhu YY, Chen XX, Wang T, Shao J, Meng XH, Huang Y, Wang H, Wang HL, Wang B, Xu DX. Prenatal 1-Nitropyrene Exposure Causes Autism-Like Behavior Partially by Altering DNA Hydroxymethylation in Developing Brain. Adv Sci (Weinh). 2024 May 16:e2306294. doi: 10.1002/advs.202306294. PubMed PMID: 38757379.
相关阅读:
技术推介|DNA羟甲基化研究:APOBEC-coupled epigenetic sequencing(ACE-Seq)
标签:Adv,Sci,ACE,暴露,甲基化,前脑,NP,KG,神经元 From: https://www.cnblogs.com/E-GENE/p/18408101