大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
喜讯!易基因表观转录组学RNA-BS技术服务见刊《ADVANCED SCIENCE》
表观遗传修饰包括有丝分裂遗传和稳定的修饰,这些修饰在不改变基础DNA序列的情况下调控基因表达。通常癌症中的表观遗传失调表现为突变、表观遗传修饰酶异常表达以及相关辅因子水平变化。其中5-甲基胞嘧啶(m5C)是一种普遍存在的RNA修饰,参与RNA代谢调控和多种肿瘤发生过程。结直肠癌(CRC)是癌症相关死亡的第二大原因,全球范围内第三大最常见的恶性肿瘤。主要的治疗方法包括手术、化疗和放疗,但CRC患者预后仍然不佳,转移性CRC的5年生存率仅为13.1%。越来越多的研究证实m5C修饰与包括膀胱癌(BLCA)、食管癌(ESCA)、胃腺癌(STAD)和肝细胞癌(LIHC)在内的多种癌症的致癌和肿瘤发生之间的复杂关系。然而,m5C修饰是否可能有助于促进CRC进展仍未充分阐明。
2024年5月20日,武汉大学中南医院江从庆教授/ Jianhong Zhao/任相海/解萧宇共同通讯在著名OA期刊《Advanced Science》发表题为“Metabolic Recoding of NSUN2-Mediated m5C Modification Promotes the Progression of Colorectal Cancer via the NSUN2/YBX1/m5C-ENO1 Positive Feedback Loop”的研究论文。研究通过RNA-Bis-seq等分析鉴定出m5C甲基转移酶NSUN2在CRC中表达水平升高及其在CRC中的致癌作用,以及潜在的遗传和分子机制。NSUN2诱导的代谢重编程以m5C依赖性方式调控ENO1表达增强葡萄糖代谢,导致CRC细胞中乳酸产生增加。此外,乳酸不仅通过组蛋白H3K18乳酸化(H3K18la)激活NSUN2转录,还诱导NSUN2在Lys356残基(K356)发生乳酸化,这对于捕获靶RNA和ENO1 mRNA m5C修饰至关重要。研究还鉴定出一种有效的NSUN2小分子抑制剂,可降低酶的功能和下游标靶表达,为CRC免疫治疗提供了一种新颖且有希望的治疗选择。总之,本研究揭示了一个NSUN2/YBX1/m5C-ENO1信号轴的正反馈回路(Positive Feedback Loop),从而连接了代谢重编程和表观遗传重塑之间的联系。易基因科技为本研究提供m5C甲基化修饰的RNA-Bis-seq技术服务。

标题:Metabolic Recoding of NSUN2-Mediated m5C Modification Promotes the Progression of Colorectal Cancer via the NSUN2/YBX1/m5C-ENO1 Positive Feedback Loop(NSUN2介导的m5C修饰的代谢重新编码通过NSUN2/YBX1/m5C-ENO1正反馈回路促进结直肠癌进展)
时间:2024.5.20
期刊:《先进科学》(Advanced Science)(中科院1区Top期刊,影响因子15.1)
实验方法: IP 和 Western blotting、mRNA BS-seq、RNA-seq、PAR-CLIP、荧光素酶报告基因检测等

研究摘要:
5-甲基胞嘧啶(m5C) RNA修饰,最近作为关键的转录后基因表达调控因子而受到关注,与多种肿瘤形成过程密切相关。然而,m5C修饰在结直肠癌(CRC)发生和进展过程中的确切机制仍不清楚。本研究鉴定出CRC中m5C甲基转移酶NSUN2表达显著升高,并发挥致癌作用。从机制上讲,NSUN2和YBX1被鉴定为ENO1的识别蛋白“writers”和阅读蛋白“readers”,最终以m5C依赖性方式重编程葡萄糖代谢,并增加乳酸产生。而CRC细胞的乳酸积累通过组蛋白H3K18乳酸化(H3K18la)激活NSUN2转录,并诱导NSUN2在Lys356残基(K356)发生乳酸化。这些结果共同揭示了一个参与NSUN2/YBX1/m5C-ENO1信号轴的正反馈回路,从而连接了代谢重编程和表观遗传重塑之间的联系,可能为将NSUN2抑制剂与免疫疗法相结合治疗CRC的治疗潜力提供线索。
结果图形:
(1)CRC中m5C水平升高和NSUN2表达增加
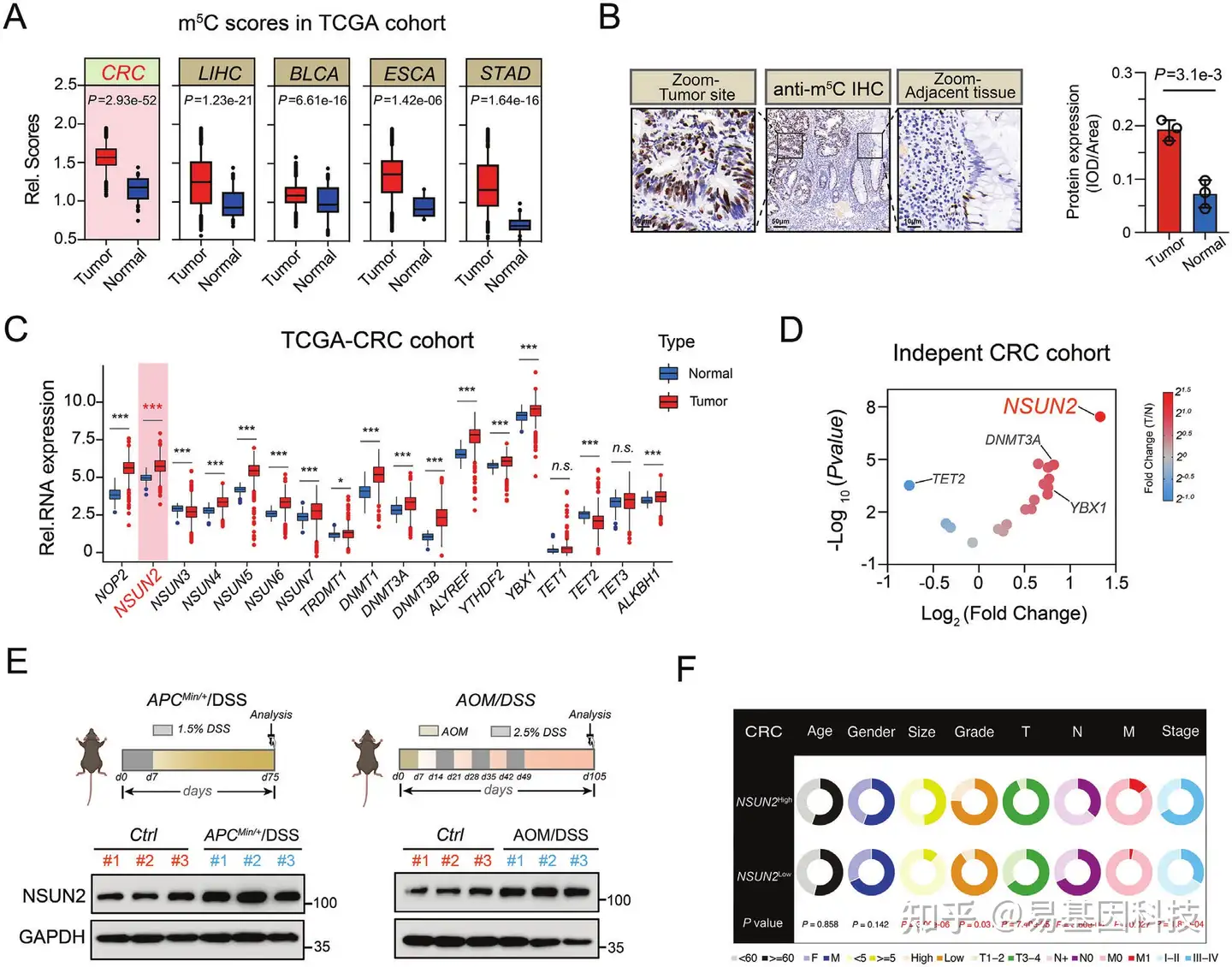
图1:结直肠癌(CRC)中m5C水平和NSUN2上调,并与CRC进展和转移相关。
- TCGA数据库中癌症和正常组织的m5C相对水平比较分析。
- CRC患者中m5C的代表性免疫组化染色(左)和定量分析(右)。
- TCGA数据库中癌症和正常组织的18个m5C调控基因相对表达比较分析。
- 在独立的配对CRC患者队列中,对18个m5C调控基因的倍数变化和P值进行等级排序分析。
- NSUN2蛋白在对照结肠组织(Ctrl)和经AOM/DSS诱导的CRC小鼠或APCMin/+/DSS诱导的CRC小鼠(APCMin/+/DSS)肿瘤组织中的表达。
- CRC队列中临床病理因素与NSUN2蛋白表达之间的关联饼图。
(2)NSUN2的缺失抑制了CRC肿瘤发生和转移
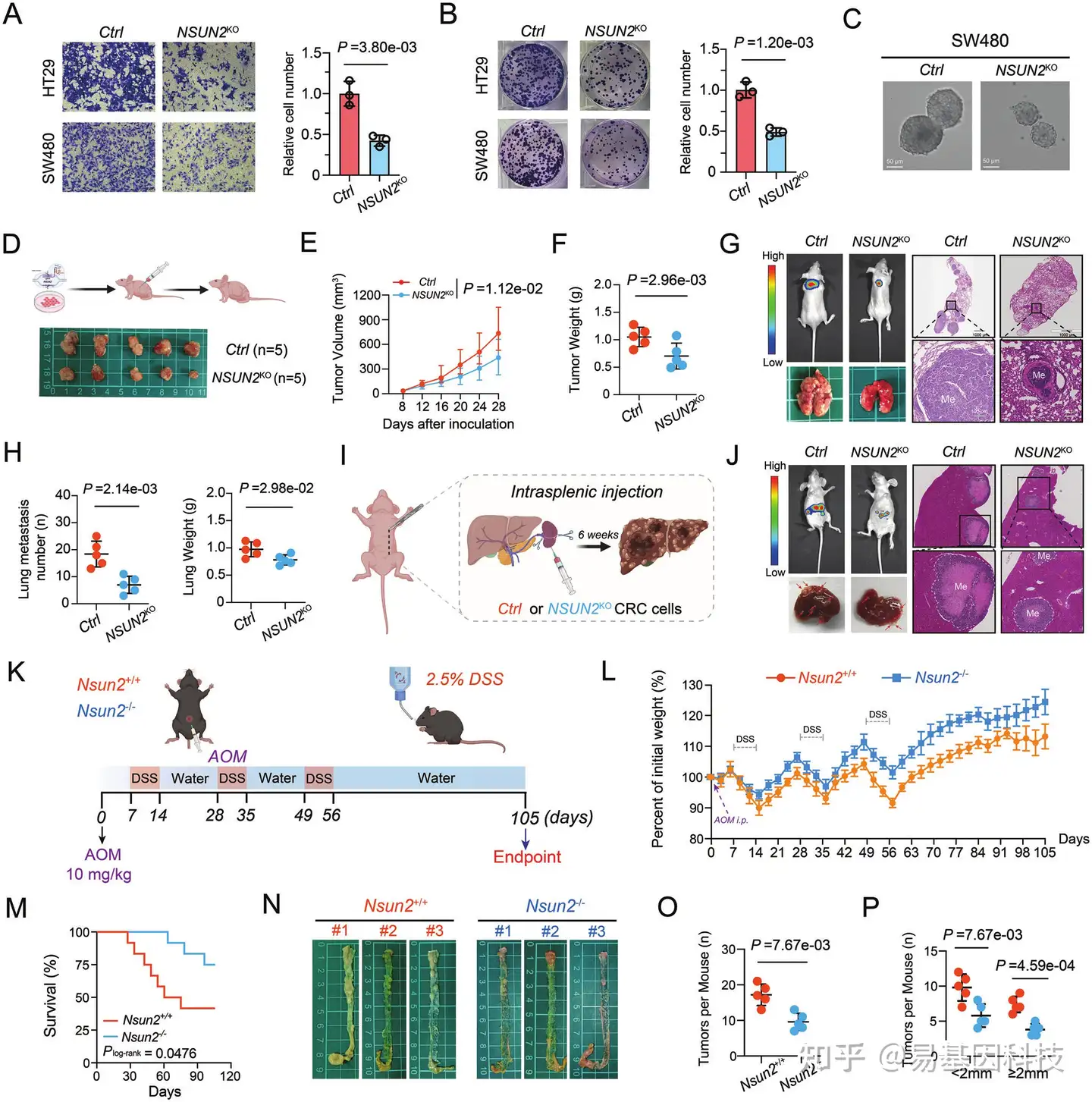
图2:NSUN2缺失在体外和体内抑制CRC的肿瘤发生和转移。
- SW480和HT29细胞中transwell实验的代表性图像(左)以及随附的条形图显示了HT29细胞的相对侵袭数(右)。
- NSUN2敲除或对照的HT29和SW480细胞的代表性集落形成结果(左),以及随附的条形图显示了HT29细胞的相对集落数(右)。
- NSUN2敲除或对照的CRC细胞的肿瘤球体形成实验的代表性图像。
- NSUN2敲除组和对照组小鼠皮下肿瘤的代表性图片。
- 通过对照或NSUN2敲除CRC细胞形成的皮下肿瘤生长曲线。
- 对照组或NSUN2敲除组形成的皮下肿瘤重量。
- 小鼠尾静脉注射对照或NSUN2敲除CRC细胞后肺转移的代表性生物发光和HE染色图像。
- 对照组或NSUN2基因敲除组的肺转移数量和肺重量统计分析。
- CRC脾内肝转移小鼠模型示意图。
- 脾脏远端注射对照或NSUN2敲除CRC细胞后小鼠肝转移的代表性生物发光和HE染色图像。
- AOM/DSS诱导的原位CRC小鼠模型示意图。
- 在AOM/DSS诱导的原位CRC模型中,Nsun2+/+和Nsun2-/-小鼠的体重曲线。
- Nsun2+/+和Nsun2-/-小鼠在AOM/DSS诱导的原位CRC模型中的存活曲线。
- AOM/DSS诱导的原位CRC模型中Nsun2+/+和Nsun2-/-小鼠的结肠肿瘤代表性图像。
- Nsun2+/+和Nsun2-/-组小鼠结肠直肠肿瘤总数比较分析。
- Nsun2+/+和Nsun2-/-组小鼠结肠直肠肿瘤数量指示大小比较分析。
(3)NSUN2介导的m5C 修饰通过靶向 CRC 中的 ENO1 导致葡萄糖代谢重编程
NSUN2是一种重要的m5C甲基转移酶,作者分析了NSUN2如何以m5C依赖性方式参与结直肠癌(CRC)的发生和进展。对NSUN2基因敲除(KO)和对照CRC细胞进行了RNA测序(RNA-Seq)和RNA亚硫酸盐测序(RNA-BiS-Seq)(图3A)。总共通过RNA-Seq鉴定了829个差异表达基因(DEGs),包括482个下调基因和347个上调基因(图3B)。基因本体(GO)分析显示,这些DEGs富集在与葡萄糖代谢相关通路中,包括经典的糖酵解、葡萄糖至丙酮酸分解过程、通过果糖-6-磷酸的糖酵解过程、NADH再生和葡萄糖分解过程(图3C)。KEGG分析显示,NSUN2缺失影响了CRC细胞中的碳代谢(中心碳代谢)和糖酵解。与这些发现一致,NSUN2基因敲除降低了SW480和HT29细胞中的葡萄糖消耗和乳酸产生,并同时抑制了细胞外酸化率(ECAR)(图3D、E)。接着,研究了NSUN2缺失如何减弱CRC细胞中的糖酵解代谢。RNA-BiS-Seq分析显示,在NSUN2基因敲除组中,不同染色体和基因区域的甲基化水平显著降低(图3F)。RNA-BiS-Seq和RNA-Seq的综合分析表明,与对照组相比,NSUN2基因敲除CRC细胞中ENO1的m5C甲基化和mRNA水平显著降低(图3G)。研究人员分析了NSUN2介导的m5C修饰对ENO1的影响。RT-qPCR分析和Western Blot分析结果表明,NSUN2敲低和基因敲除显著降低了CRC细胞中ENO1 mRNA(图3H)和蛋白水平(图3I),而NSUN2过表达则结果相反(图3H、I)。使用ENO1特异性引物的亚硫酸盐PCR测序(BSP)结果表明,在NSUN2缺失的CRC细胞中,ENO1位点甲基化沉默(图3J)。在TCGA数据分析中,NSUN2的RNA表达与CRC中ENO1水平呈显著正相关(图3K)。为了进一步验证NSUN2在调控ENO1的致癌功能是否依赖于m5C甲基转移酶活性,通过在释放位点(半胱氨酸271)或催化位点(半胱氨酸321)引入点突变,构建了两个非功能性NSUN2突变体,目的是破坏其m5C酶活性。结果表明,确实只有野生型(WT)NSUN2过表达才能在NSUN2KO CRC细胞中恢复ENO1 mRNA(图3L)和蛋白水平(图3M)。NSUN2介导的m5C修饰可能通过增加mRNA稳定性来维持ENO1表达。如图3N,O所示,在NSUN2KO细胞中,ENO1 RNA的半衰期在使用放线菌素D处理后显著降低,而NSUN2WT过表达逆转了这种降低,但NSUN2C271A或NSUN2C321A突变体则没有。同样的,在AOM/DSS诱导的Nsun2+/+小鼠中观察到的组织学异常中ENO1的水平也高于Nsun2-/-小鼠(图3P)。在体外拯救实验中,ENO1过表达逆转了NSUN2基因敲除CRC细胞中的增殖和侵袭能力下降,以及葡萄糖代谢的下降(图3Q)。但在体内实验中,ENO1基因敲除背景下NSUN2过表达未能有效恢复降低的皮下植入CRC肿瘤,表明ENO1可能是NSUN2的一个关键下游靶标(图3R–T)。所有这些发现证明了ENO1在NSUN2介导的m5C修饰中的关键作用,有助于CRC中葡萄糖代谢的重编程。
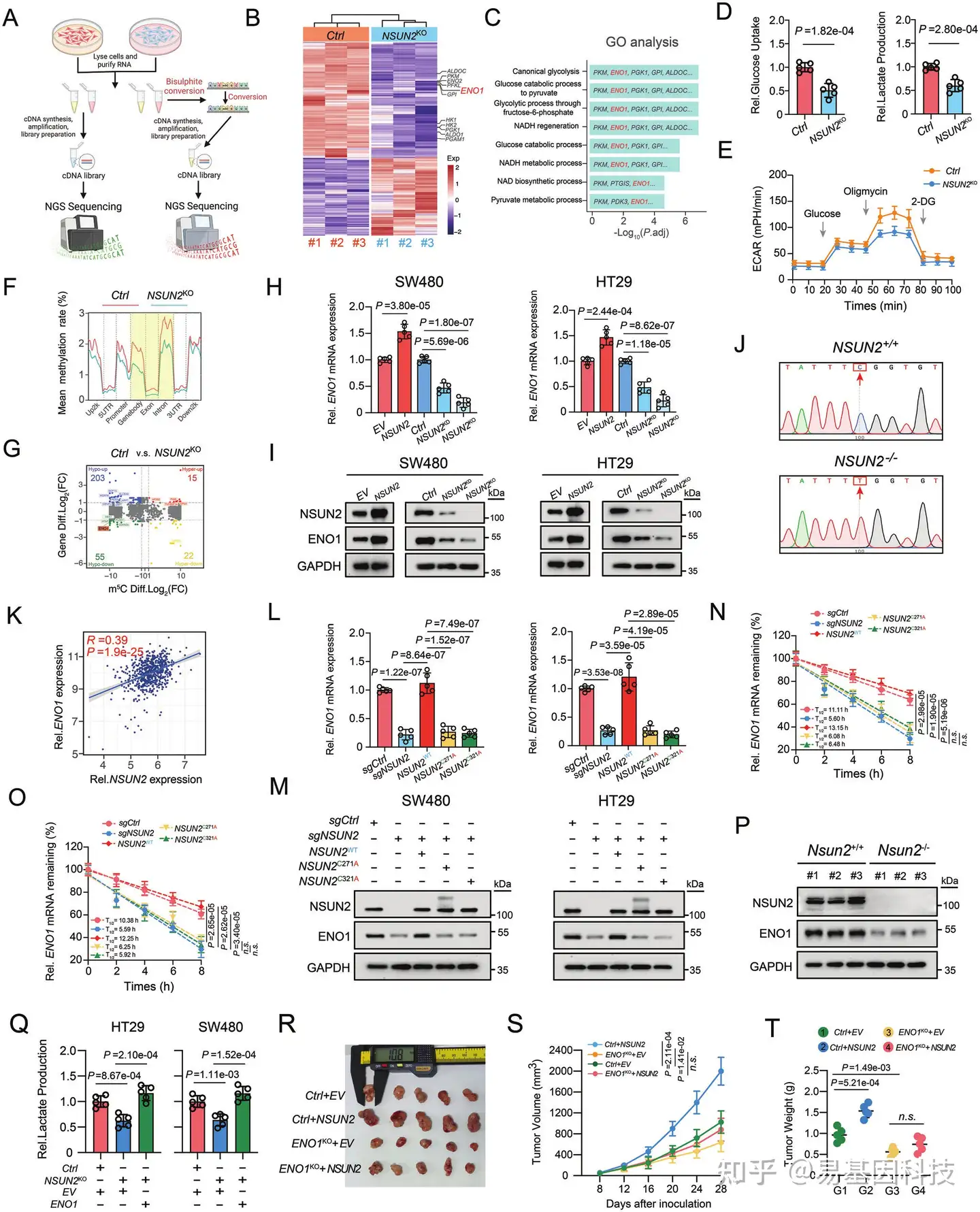
图3:NSUN2介导的m5C修饰通过靶向CRC中的ENO1导致葡萄糖代谢重编程。
- CRC细胞中RNA-Seq和RNA-BiS-Seq过程插图。
- 对照组和NSUN2基因敲除组的基因表达差异热图。
- 对照组和NSUN2基因敲除CRC细胞组差异表达基因的GO分析。
- 对照组和NSUN2基因敲除SW480细胞之间相对葡萄糖摄取和乳酸产生比较。
- 对照组和NSUN2基因敲除SW480细胞的ECAR分析。
- 对照组和NSUN2基因敲除组的不同基因组区域平均甲基化水平比较。
- RNA-Seq和RNA-BiS-Seq综合分析鉴定基因表达和m5C甲基化水平上显著变化的mRNAs分布。
H-I. 指定载体处理后CRC细胞中ENO1的mRNA和蛋白表达水平分析。
J. Sanger分析对照和NSUN2基因敲除CRC细胞ENO1 RNA中的m5C位点。
K. TCGA-CRC数据库中ENO1和NSUN2相对mRNA表达水平的相关性分析。
L-M. 指定载体处理后CRC细胞中ENO1的相对mRNA和蛋白表达水平。
N-O. SW480和HT29细胞经指定载体处理后ENO1 mRNA半衰期分析。
P. 在AOM/DSS诱导的CRC模型中,Nsun2+/+和Nsun2-/-小鼠肿瘤组织中NSUN2和ENO1蛋白表达水平。
Q. 在NSUN2基因敲除CRC细胞中ENO1过表达后乳酸产生的拯救实验。
R. 荷瘤小鼠体内拯救模型(每组n=5只小鼠)的解剖皮下肿瘤图像。
S. 每4天检测一次的荷瘤小鼠皮下肿瘤体积的时间进程评估。
T. 指定组别皮下肿瘤最终重量散点图。
(4)YBX1作为m5C reader识别和稳定ENO1
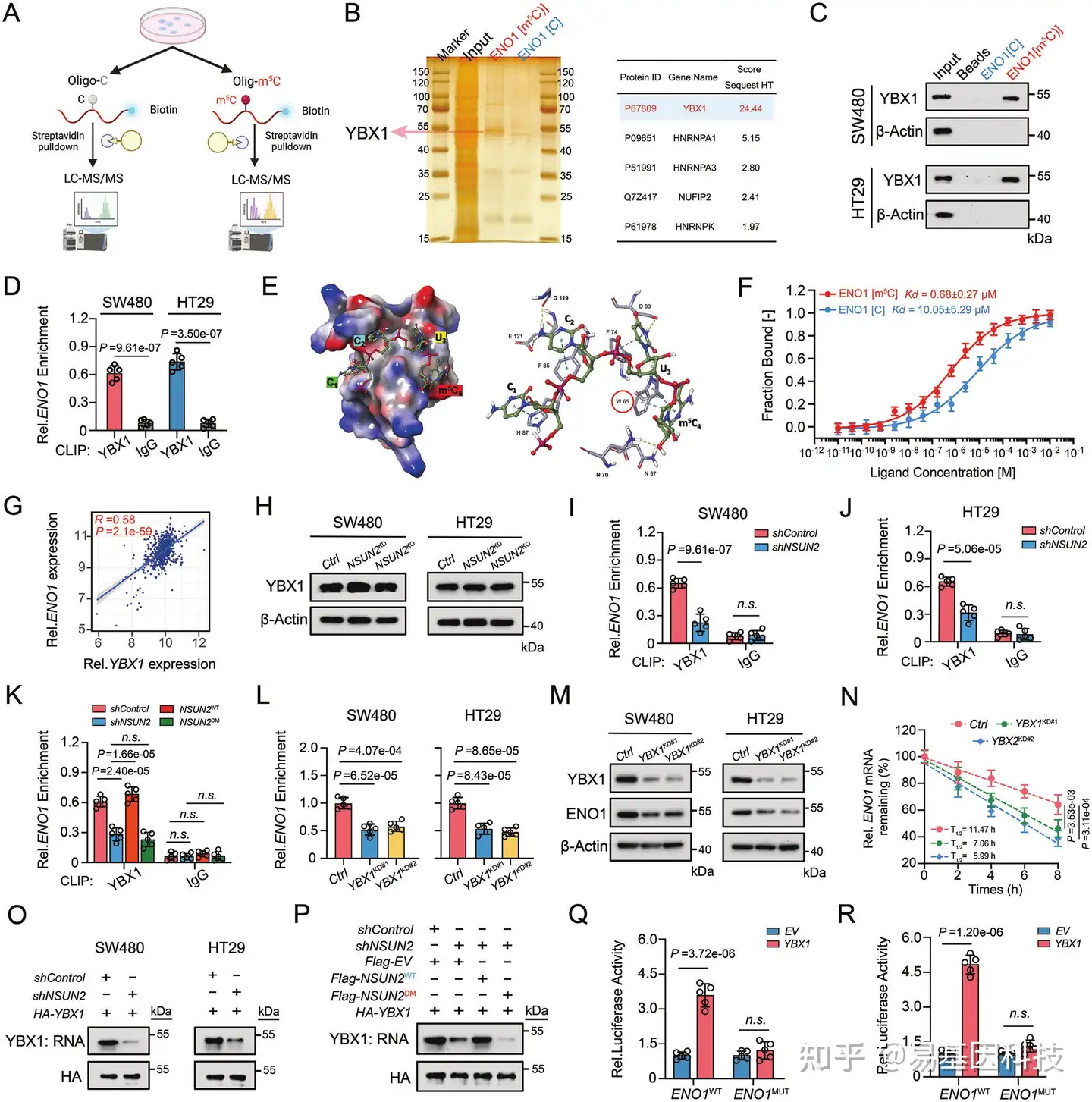
图4:YBX1作为m5C reader,识别和稳定ENO1 mRNA。
- CRC细胞中RNA下拉和质谱分析过程插图。
- 使用SDS/PAGE随后用银染法对Input和RNA下拉蛋白质进行分析。
- 质谱分析后,从RNA下拉获得的潜在ENO1[m5C]结合蛋白进行Western blotting分析。
- CRC细胞中YBX1与ENO1结合能力的PAR-CLIP-qPCR分析。
- YBX1 CSD和ENO1 m5C RNA寡聚物复合物表面静电电势。YBX1 CSD结构域对m5C的识别。
- 通过MST定量分析未修饰或m5C修饰的ENO1 RNA低聚物与YBX1-CSD的结合亲和力。
- TCGA-CRC数据库中ENO1和YBX1相对mRNA表达水平的相关性分析。
- NSUN2敲低或基因敲除的CRC细胞中YBX1蛋白水平的Western blotting分析。
- 在NSUN2敲低的SW480细胞中YBX1与ENO1 RNA结合能力的PAR-CLIP-qPCR分析。
- 在NSUN2敲低的HT29细胞中YBX1与ENO1 RNA结合能力的PAR-CLIP-qPCR分析。
- YBX1在SW480细胞中与ENO1 RNA结合能力的PAR-CLIP-qPCR分析。
- YBX1敲低的CRC细胞中ENO1 mRNA相对表达水平的RT-qPCR分析。
- YBX1敲低的CRC细胞中ENO1蛋白相对表达水平的Western blotting分析。
- YBX1敲低SW480细胞ENO1 mRNA的RNA半衰期分析。
- NSUN2基因敲除的SW480和HT29细胞中,通过HA-YBX1下拉的RNA的PAR-CLIP分析。
- 在NSUN2基因敲除并转染Flag-EV、Flag-NSUN2WT或Flag-NSUN2DM的SW480细胞中,由HA-YBX1敲低的RNA的Rescue PAR-CLIP分析。
- 在对照或稳定的YBX1过表达SW480细胞中野生型ENO1-m5C位点(ENO1WT)或突变m5C位点(ENO1MUT)的荧光素酶报告基因分析。
- 在对照或稳定的YBX1过表达HT29细胞中ENO1WT或ENO1MUT的荧光素酶报告基因分析。
(5)肿瘤源性乳酸通过组蛋白乳酰化诱导NSUN2表达上调
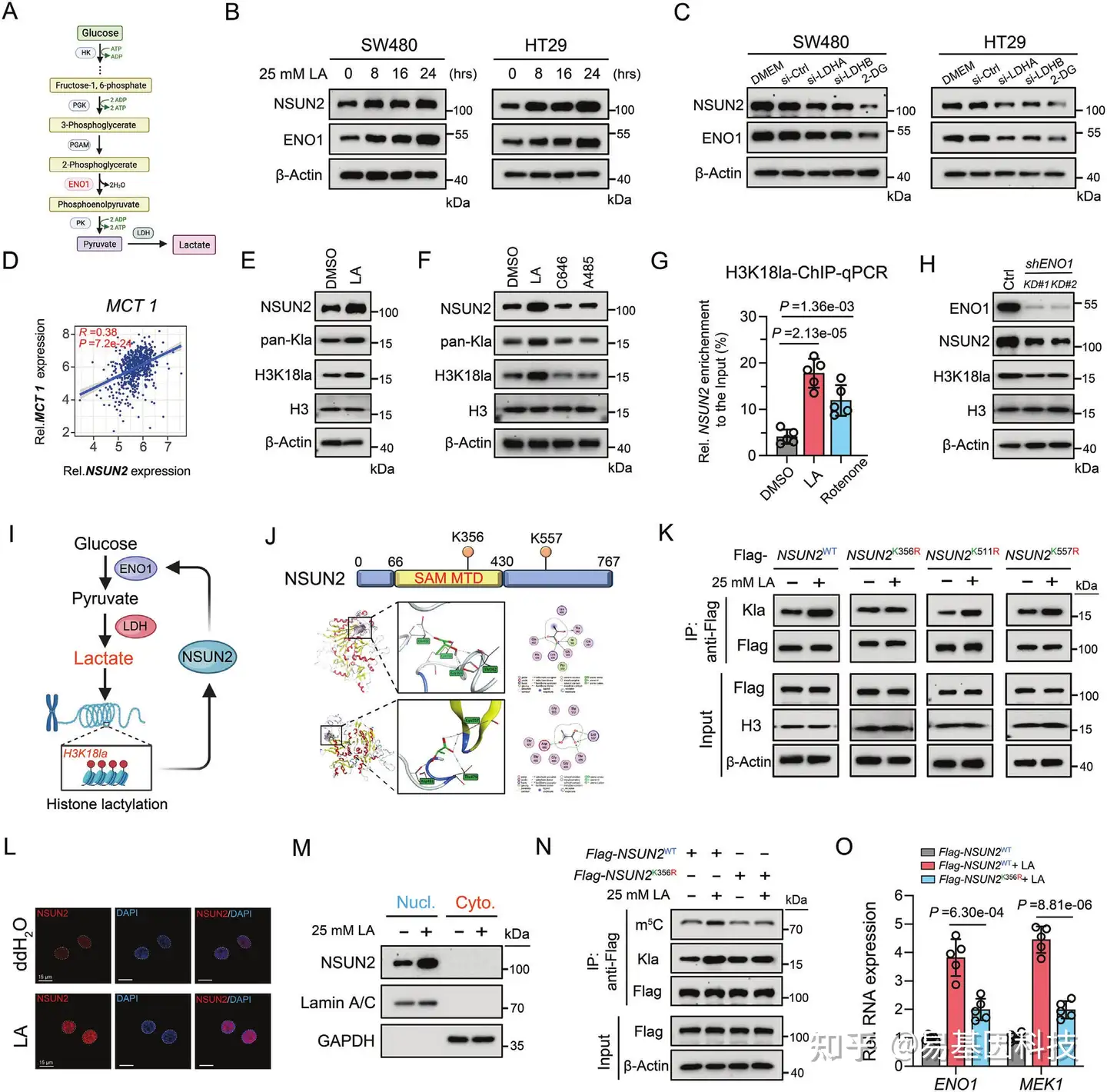
图5:肿瘤源性乳酸通过组蛋白H3K18乳酸化激活NSUN2转录,并直接诱导K356位点的NSUN2乳酸化。
- 说明ENO1在葡萄糖代谢中功能作用的代谢流程图。
- 对经25 mM L-乳酸处理指定时间的CRC细胞全细胞裂解液中指定蛋白的Western blotting分析。
- 经si-NC或si-LDHA或si-LDHB或2-DG处理的CRC细胞中NSUN2和ENO1蛋白水平的Western blotting分析。
- 在TCGA-CRC数据库中,NSUN2与MCT1相对mRNA表达水平的相关性分析。
- 对添加25 mM L-乳酸的CRC细胞全细胞裂解液中指定蛋白水平的Western blotting分析。
- 对经25 mM L-乳酸处理24小时或经组蛋白乙酰转移酶p300抑制剂(C646或A485)处理24小时的CRC细胞全细胞裂解液中指定蛋白的Western blotting分析。
- 对经25 mM L-乳酸或500 nM rotenone处理24小时的CRC细胞中NSUN2相对于Input水平进行ChIP-qPCR分析。
- ENO1敲低CRC细胞全细胞裂解液中指定蛋白的Western blotting分析。
- 说明NSUN2通过ENO1调控促进NSUN2转录形成正反馈回路图表。
- 用于预测NSUN2和L-乳酸分子之间结合亲和力的分子对接。
L. 对经25 mM L-乳酸处理或未处理24小时的CRC细胞核和细胞质部分中NSUN2相对表达的Western blotting分析。
M. 对经25 mM L-乳酸处理或未处理24小时的SW480细胞中NSUN2蛋白的免疫荧光分析。
N. 对经指定载体和L-乳酸处理并在UV交联后的CRC细胞中指定目标的免疫沉淀和Western blotting分析。
O. 对不同处理的CRC细胞中相对RNA表达水平的RT-qPCR分析。
(6)NSUN2小分子高效抑制剂与免疫疗法联合应用鉴定
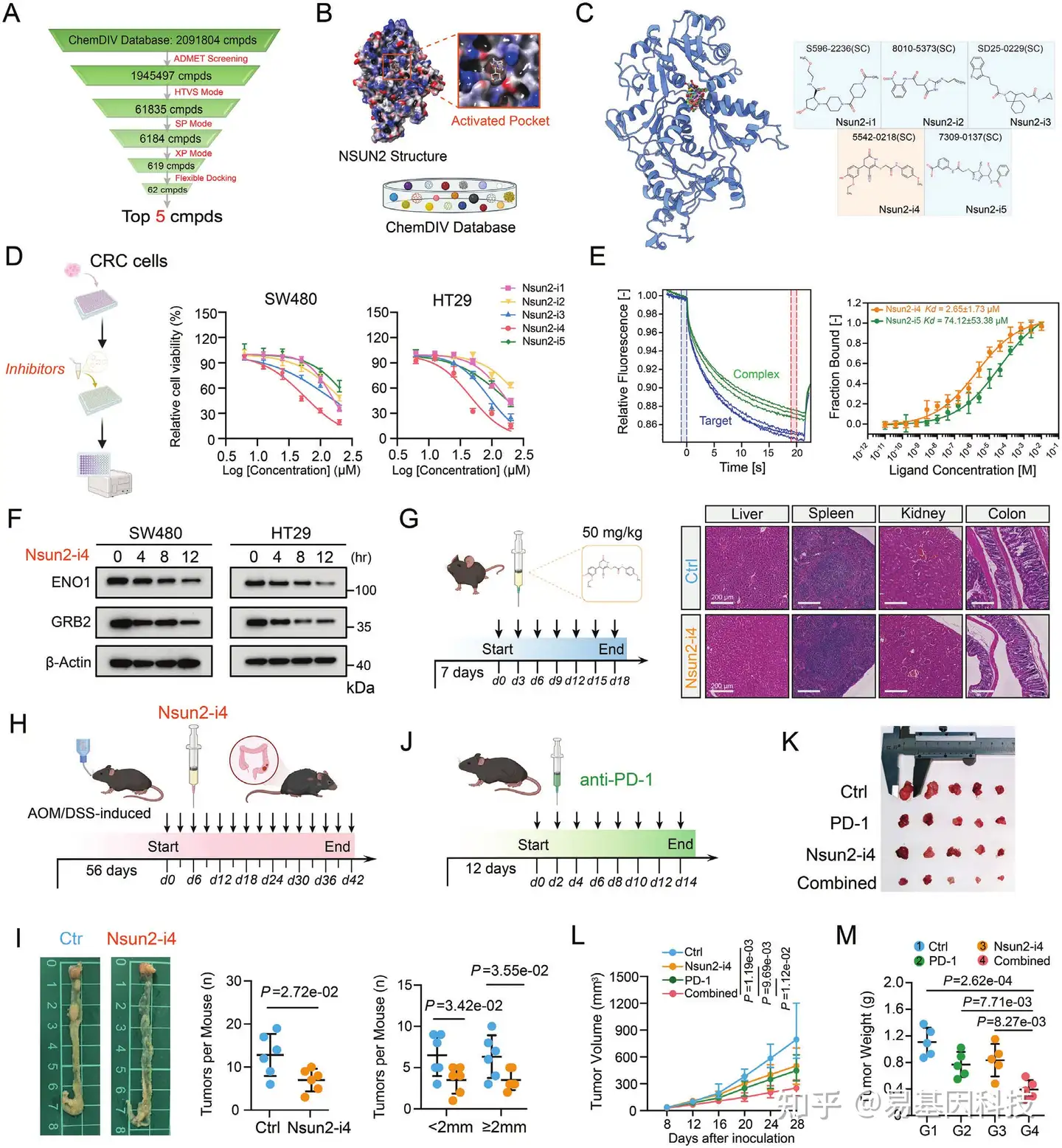
图6:鉴定出一种有效的NSUN2小分子抑制剂及其与免疫疗法的联合应用。
- 从ChemDIV数据库中鉴定NSUN2抑制剂的金字塔流程图。
- 基于NSUN2晶体结构的活性口袋和2091804种化合物开发了对接模型。
- 前5种抑制剂在NSUN2蛋白催化中心的对接姿态(左)。这5种小分子抑制剂的2D结构(右)。
- 使用小分子抑制剂Nsun2-i4处理后的CRC细胞的CCK8分析。
- Nsun2-i4抑制剂与NSUN2蛋白之间互作的MST分析。
- 在SW480和HT29细胞系中暴露于15 μM Nsun2-i4 12小时后的指定蛋白的Western blotting分析。
- 小分子抑制剂(Nsun2-i4)在C57BL/6N小鼠中的给药示意图(左)。经Nsun2-i4处理的小鼠模型的肝脏、脾脏、肾脏和结肠的HE染色(右)。
- AOM/DSS诱导的正位小鼠模型中NSUN2小分子抑制剂(Nsun2-i4)的示意图。
- 在AOM/DSS诱导的原位CRC模型中,对照组和Nsun2-i4处理组小鼠的结肠肿瘤典型图像(左)。对照组和Nsun2-i4组小鼠结肠肿瘤总数比较(中)。对照组和Nsun2-i4组小鼠指定大小的结肠肿瘤数量比较(右)。
- 小分子抑制剂(Nsun2-i4)和PD-1在同源C57BL/6N小鼠中的联合疗法效果示意图。
- 在同源C57BL/6N模型结束时,来自荷瘤小鼠的皮下肿瘤的解剖图像(每组n=5只小鼠)。
- 在C57BL/6N小鼠中每4天测量一次的皮下肿瘤体积的时间进程评估。
- 指定组别皮下肿瘤最终重量散点图。
(7)NSUN2和ENO1与CRC患者葡萄糖代谢相关
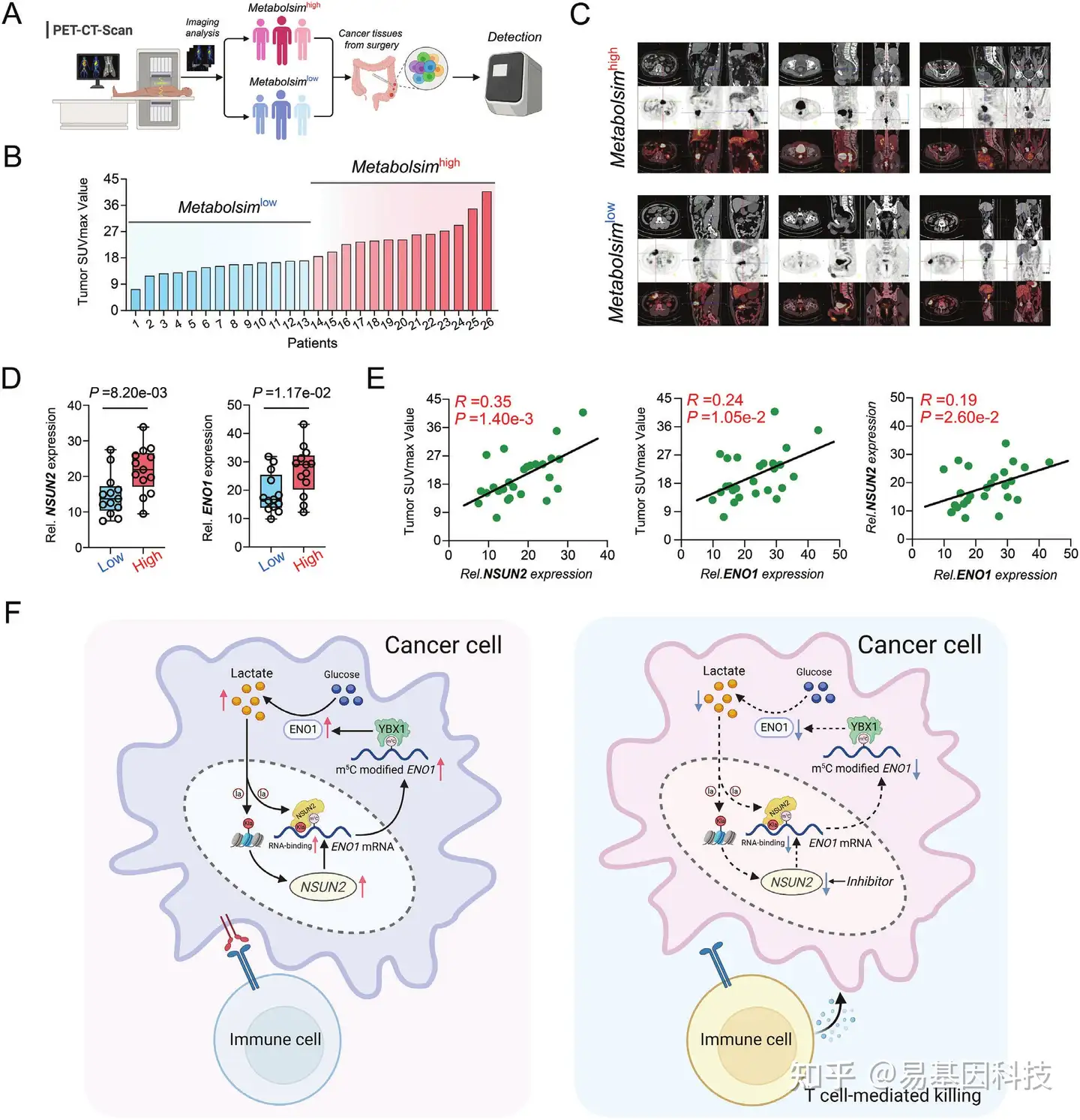
图7:NSUN2和ENO1与结直肠癌(CRC)患者的葡萄糖代谢相关。
- 临床CRC患者组织与PET-CT结果整合及葡萄糖代谢分析示意图。
- CRC患者基于PET-CT SUVmax值的葡萄糖代谢的排名表。
- CRC患者高葡萄糖代谢组和低葡萄糖代谢组的代表性PET-CT图像。
- 在高代谢和低代谢组中NSUN2(左)和ENO1(右)的相对RNA表达水平。
- NSUN2相对RNA表达水平与肿瘤SUVmax(左)的相关性分析。ENO1相对RNA表达水平与肿瘤SUVmax(中)的相关性分析。CRC患者中NSUN2与ENO1相对RNA表达水平(右)的相关性分析。
- 本研究提出的关键发现的示意图总结。
研究总结:
本研究揭示了一个非常有趣的正反馈回路,在该回路中,NSUN2促进并稳定ENO1 mRNA,然后增强糖酵解并增加由于ENO1上调而产生的乳酸,回过来又刺激NSUN2转录。因此,靶向NSUN2可能破坏这一正反馈回路。最近研究进展表明,乳酸作为调节性T细胞(Treg细胞)的代谢检查点,并通过上调PD-1表达调控肿瘤微环境中的免疫反应。此外,研究鉴定了NSUN2激活维持了整体m5C RNA甲基化,并稳定TREX2以限制细胞质dsDNA积累和cGAS/STING激活,最终促进肿瘤发生和对anti-PD-L1免疫疗法的抗性。为了提高这项研究的潜在临床适用性,本研究使用基于分子对接的虚拟筛选从ChemDIV数据库中筛选出NSUN2的小分子抑制剂,并确定Nsun2i-4为一种在体内无明显毒性的有效抑制剂。采用CRC同源小鼠模型进一步评估NSUN2抑制剂与PD-1阻断联合的疗效,令人鼓舞的结果支持了NSUN2在CRC癌症免疫疗法中的潜力。最终,通过使用PET-CT和TCGA数据库的大规模基因组测序数据对独立的临床CRC队列进行分析,验证了这一调控轴的可靠性。独立临床队列结果和TCGA数据分析进一步证实了高葡萄糖代谢组中NSUN2和ENO1表达水平升高。与TCGA-CRC队列中糖酵解低/NUN2低/ENO1低特征的患者相比,糖酵解高/NSUN2高/ENO1高特征的患者分别显示出显著的生存益处。
总之,本研究专注NSUN2/YBX1/m5C-ENO1信号轴的大量工作可能为结直肠癌的发病机制和表观遗传-免疫靶标的鉴定提供有价值的见解。
关于易基因RNA m5C甲基化测序(RNA-BS)技术
m5C是RNA百余种修饰中研究较多的一种。m5C存在于tRNA上时,可以对翻译进行调节;存在于rRNA上时,可以对核糖体的生物合成进行质控;存在于mRNA上时,则可以影响mRNA的结构、稳定性及翻译过程。
易基因提供适用于不同科研需求的m5C甲基化测序技术:
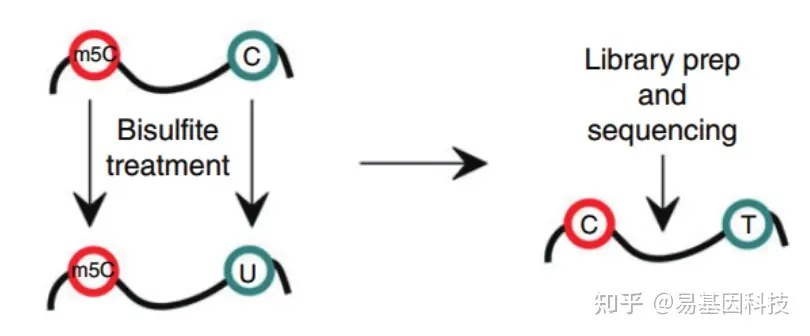
- 常规mRNA m5C甲基化测序(RNA-BS):
mRNA分离后首先通过亚硫酸盐处理,非甲基化的C转变为U,m5C修饰的碱基保持不变,结合高通量测序,可以对RNA上的每一个C碱基修饰进行定位与定量。 - 常规mRNA +lncRNA m5C甲基化测序(全转录组RNA-BS):
易基因科技建立的升级版m5C RNA甲基化测序服务,去除人rRNA后,剩余RNA经重亚硫酸盐处理后,结合高通量NGS策略,可在全转录组范围内单碱基分辨率地检测基因m5C甲基化修饰分布。
技术优势:
- 高深度:超高深度重亚硫酸盐处理,检测准确性极高;
- 高通量:结合高通量NGS,全转录组范围内检测;
- 单碱基:单碱基分辨率,快速检测和分析RNA中的m5C。
- 高准确:精确的检测mRNA等每一个C碱基的的修饰水平。
研究方向:
- 与m6A甲基化类似,m5C甲基化已被证明与肿瘤、神经系统紊乱、代谢性疾病、病毒感染以及个体发育等密切相关。
- 此外,RNA甲基化(m5C)与人类疾病密切相关,其功能涉及调控干细胞应激、细胞毒性应激、mRNA出核和植物细胞发育及基因表达等方面。
实验策略:
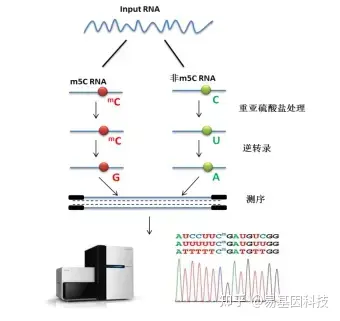 易基因RNA m5C甲基化建库测序示意图
易基因RNA m5C甲基化建库测序示意图
易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化)和表观转录组学(m6A、m5C、m1A、m7G)、染色质结构与功能组学技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900.

参考文献:
Chen B, Deng Y, Hong Y, Fan L, Zhai X, Hu H, Yin S, Chen Q, Xie X, Ren X, Zhao J, Jiang C. Metabolic Recoding of NSUN2-Mediated m5C Modification Promotes the Progression of Colorectal Cancer via the NSUN2/YBX1/m5C-ENO1 Positive Feedback Loop. Adv Sci (Weinh). 2024 May 20:e2309840. doi: 10.1002/advs.202309840. PubMed PMID: 38769664.
相关阅读:
项目文章 | NAR:RCMS编辑系统在特定细胞RNA位点的靶向m5C甲基化和去甲基化研究
干货:手把手教你做RNA m5C甲基化测序分析(RNA-BS)
标签:Adv,Sci,ENO1,RNA,NSUN2,细胞,CRC,m5C From: https://www.cnblogs.com/E-GENE/p/18219883