 胶质母细胞瘤(GBM)呈现出免疫抑制性的肿瘤微环境(抑制T细胞浸润、激活及作用),也限制了免疫疗法的疗效。在GBM中,胶质母细胞瘤干细胞(GCS)的自我更新会促进细胞分化并产生耐药性。氨基酸代谢会影响T细胞的活化和功能,限制氨基酸摄入可以有效抑制体内的肿瘤生长。赖氨酸代谢会产生多种生物活性物质,如巴豆酰辅酶A。巴豆酰辅酶A作为组蛋白巴豆酰化修饰(Kcr)的前体物质,会影响局部染色体的微环境进而调节干细胞分化,但其在肿瘤中的作用尚不明确。
2023年5月17日,匹兹堡大学医学中心的Jeremy N Rich教授、Nathaniel W. Snyder教授与芝加哥大学的赵英明教授团队合作在Nature上发表了题为“Lysine catabolism reprograms tumour immunity through histone crotonylation”的研究论文。该文章发现胶质母细胞瘤干细胞存在赖氨酸代谢重编程进而产生巴豆酰辅酶A,增加细胞整体巴豆酰化修饰水平,特别是组蛋白H4巴豆酰化修饰水平。组蛋白巴豆酰化修饰会影响H3K27ac和H3K9me3,影响干扰素信号以及CD8+T细胞浸润,最终促进肿瘤生长。景杰生物为该研究提供了巴豆酰化修饰抗体支持。
胶质母细胞瘤(GBM)呈现出免疫抑制性的肿瘤微环境(抑制T细胞浸润、激活及作用),也限制了免疫疗法的疗效。在GBM中,胶质母细胞瘤干细胞(GCS)的自我更新会促进细胞分化并产生耐药性。氨基酸代谢会影响T细胞的活化和功能,限制氨基酸摄入可以有效抑制体内的肿瘤生长。赖氨酸代谢会产生多种生物活性物质,如巴豆酰辅酶A。巴豆酰辅酶A作为组蛋白巴豆酰化修饰(Kcr)的前体物质,会影响局部染色体的微环境进而调节干细胞分化,但其在肿瘤中的作用尚不明确。
2023年5月17日,匹兹堡大学医学中心的Jeremy N Rich教授、Nathaniel W. Snyder教授与芝加哥大学的赵英明教授团队合作在Nature上发表了题为“Lysine catabolism reprograms tumour immunity through histone crotonylation”的研究论文。该文章发现胶质母细胞瘤干细胞存在赖氨酸代谢重编程进而产生巴豆酰辅酶A,增加细胞整体巴豆酰化修饰水平,特别是组蛋白H4巴豆酰化修饰水平。组蛋白巴豆酰化修饰会影响H3K27ac和H3K9me3,影响干扰素信号以及CD8+T细胞浸润,最终促进肿瘤生长。景杰生物为该研究提供了巴豆酰化修饰抗体支持。


图1 本文研究思路示意图
1 胶质母细胞瘤干细胞(GSC)特异性增加赖氨酸摄取并促进肿瘤生长通过代谢组学分析,研究者发现与匹配的分化胶质母细胞瘤细胞(DGC)相比,GSC中存在赖氨酸、叶酸、嘧啶、嘌呤和精氨酸代谢相关通路的富集。已有研究发现,叶酸、嘧啶和嘌呤代谢维持 GSC 并促进胶质母细胞瘤生长,但赖氨酸代谢在其中的作用还未有报道。研究者使用质谱检测患者来源的GSC、匹配的DGC和神经干细胞(NSC)中的游离氨基酸水平,发现GSC中的赖氨酸持续增加。进一步地,研究者检测了负责转运赖氨酸的SLC7A1、SLC7A2和SLC7A3的含量变化,发现GSC中SLC7A2的启动子激活和表达增加。最后,研究者发现在GSC细胞及小鼠模型中敲低SLC7A2会显著影响GSC生长以及肿瘤发生。上述研究结果表明了赖氨酸对肿瘤的重要作用,并发现GSC中SLC7A2表达上调可特异性增加赖氨酸摄取并促进肿瘤生长。
图1 本文研究思路示意图
1 胶质母细胞瘤干细胞(GSC)特异性增加赖氨酸摄取并促进肿瘤生长通过代谢组学分析,研究者发现与匹配的分化胶质母细胞瘤细胞(DGC)相比,GSC中存在赖氨酸、叶酸、嘧啶、嘌呤和精氨酸代谢相关通路的富集。已有研究发现,叶酸、嘧啶和嘌呤代谢维持 GSC 并促进胶质母细胞瘤生长,但赖氨酸代谢在其中的作用还未有报道。研究者使用质谱检测患者来源的GSC、匹配的DGC和神经干细胞(NSC)中的游离氨基酸水平,发现GSC中的赖氨酸持续增加。进一步地,研究者检测了负责转运赖氨酸的SLC7A1、SLC7A2和SLC7A3的含量变化,发现GSC中SLC7A2的启动子激活和表达增加。最后,研究者发现在GSC细胞及小鼠模型中敲低SLC7A2会显著影响GSC生长以及肿瘤发生。上述研究结果表明了赖氨酸对肿瘤的重要作用,并发现GSC中SLC7A2表达上调可特异性增加赖氨酸摄取并促进肿瘤生长。
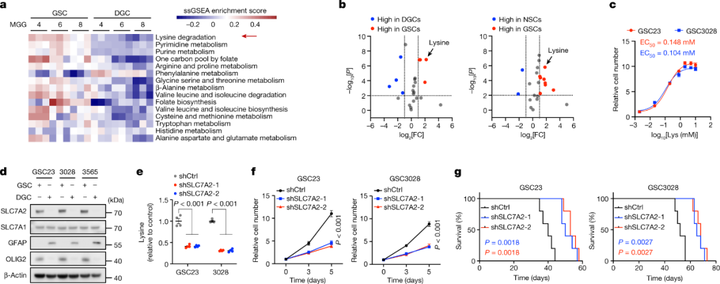
图2 GSC通过SLC7A2上调赖氨酸分解代谢
2 GSC 重编程赖氨酸分解代谢以促进 Kcr 和肿瘤发生
赖氨酸追踪分析表明,GSC中赖氨酸向乙酰辅酶A的转化增加。其中参与代谢产生巴豆酰辅酶A的戊二酰辅酶A脱氢酶-GCDH的表达增加。相比之下,参与将巴豆酰辅酶A分解代谢的关键限速酶-ECHS1在典型的GBM样本中表达降低。表明GSC中发生赖氨酸代谢重编程,通过上调GCDH和下调ECHS1积累巴豆酰辅酶A。而巴豆酰辅酶A作为蛋白质巴豆酰化修饰Kcr的前体,参与蛋白的结构与功能调节。研究者比较了GSC和匹配的DGC中组蛋白Kcr、组蛋白戊二酰化(Kglu)和组蛋白乙酰化(Kac)水平,以及与赖氨酸分解代谢相关的酶的表达量。分析发现Kcr在GSC中特异性增强,但戊二酰辅酶A或短链脂肪酸没有增加,且Kcr主要富集在组蛋白H4上。在小鼠中移植敲低GCDH的GSC细胞可以显著提高小鼠的存活率,而ECHS1过表达则减弱了GSC中组蛋白Kcr以及细胞增殖。综上,研究者证实了GSC中存在赖氨酸分解代谢重编程,通过增强GCDH和降低ECHS1表达来促进组蛋白Kcr和肿瘤生长。
图2 GSC通过SLC7A2上调赖氨酸分解代谢
2 GSC 重编程赖氨酸分解代谢以促进 Kcr 和肿瘤发生
赖氨酸追踪分析表明,GSC中赖氨酸向乙酰辅酶A的转化增加。其中参与代谢产生巴豆酰辅酶A的戊二酰辅酶A脱氢酶-GCDH的表达增加。相比之下,参与将巴豆酰辅酶A分解代谢的关键限速酶-ECHS1在典型的GBM样本中表达降低。表明GSC中发生赖氨酸代谢重编程,通过上调GCDH和下调ECHS1积累巴豆酰辅酶A。而巴豆酰辅酶A作为蛋白质巴豆酰化修饰Kcr的前体,参与蛋白的结构与功能调节。研究者比较了GSC和匹配的DGC中组蛋白Kcr、组蛋白戊二酰化(Kglu)和组蛋白乙酰化(Kac)水平,以及与赖氨酸分解代谢相关的酶的表达量。分析发现Kcr在GSC中特异性增强,但戊二酰辅酶A或短链脂肪酸没有增加,且Kcr主要富集在组蛋白H4上。在小鼠中移植敲低GCDH的GSC细胞可以显著提高小鼠的存活率,而ECHS1过表达则减弱了GSC中组蛋白Kcr以及细胞增殖。综上,研究者证实了GSC中存在赖氨酸分解代谢重编程,通过增强GCDH和降低ECHS1表达来促进组蛋白Kcr和肿瘤生长。
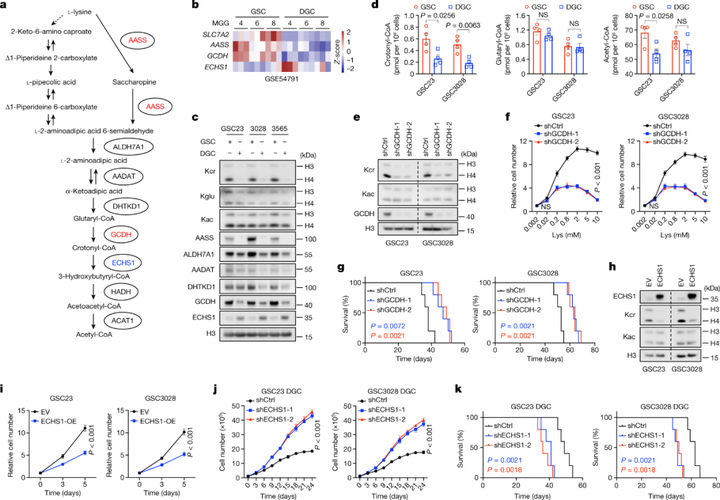
图3 GSC重编程赖氨酸分解代谢以促进Kcr和肿瘤发生
3 Kcr影响干扰素信号调节GSC命运
为了进一步确定靶向GCDH或ECHS1对GSC的影响,研究者进一步通过RNA-seq分析发现GCDH敲低诱导了308个基因表达,其中I型干扰素(IFN)信号在上调基因中显著富集。进一步地,将野生型GCDH重新引入后降低了IFN通路的激活,表明GCDH催化活性对IFN信号抑制的重要性。此外,与GSCs GCDH 的功能相反,RNA-seq分析发现在DGC中敲低ECHS1降低了IFN信号传导的激活,降低了衰老标记物的蛋白质水平并增加了Kcr。
IFN 信号通过诱导衰老和抑制增殖以及通过调节免疫反应来抑制肿瘤生长。研究者发现,GCDH缺失两天后细胞周期蛋白依赖性激酶抑制剂表达没有改变,但IFN信号被激活,表明增强的IFN信号似乎是细胞周期停滞的原因。在GSC衍生的颅内肿瘤中,GCDH敲低后GSC比例降低,使用人IFNAR阻断抗体治疗后可以得到恢复。因此,研究者证实了由赖氨酸分解代谢失调而诱导的IFN信号转导调控GSC命运。
图3 GSC重编程赖氨酸分解代谢以促进Kcr和肿瘤发生
3 Kcr影响干扰素信号调节GSC命运
为了进一步确定靶向GCDH或ECHS1对GSC的影响,研究者进一步通过RNA-seq分析发现GCDH敲低诱导了308个基因表达,其中I型干扰素(IFN)信号在上调基因中显著富集。进一步地,将野生型GCDH重新引入后降低了IFN通路的激活,表明GCDH催化活性对IFN信号抑制的重要性。此外,与GSCs GCDH 的功能相反,RNA-seq分析发现在DGC中敲低ECHS1降低了IFN信号传导的激活,降低了衰老标记物的蛋白质水平并增加了Kcr。
IFN 信号通过诱导衰老和抑制增殖以及通过调节免疫反应来抑制肿瘤生长。研究者发现,GCDH缺失两天后细胞周期蛋白依赖性激酶抑制剂表达没有改变,但IFN信号被激活,表明增强的IFN信号似乎是细胞周期停滞的原因。在GSC衍生的颅内肿瘤中,GCDH敲低后GSC比例降低,使用人IFNAR阻断抗体治疗后可以得到恢复。因此,研究者证实了由赖氨酸分解代谢失调而诱导的IFN信号转导调控GSC命运。
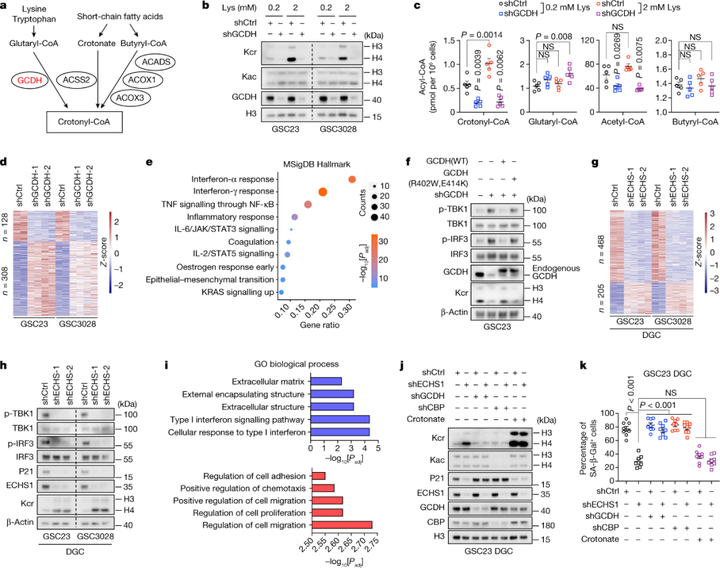
图4 赖氨酸分解代谢的重编程影响 I 型干扰素信号
4 细胞核GCDH与CBP结合并提高Kcr
约20%的GCDH定位于细胞核,而且除了ECHS1,其他赖氨酸降解酶也部分定位于细胞核,表明赖氨酸分解代谢可能对细胞核存在重要影响。因此研究者进一步探索了GCDH是否能直接连接组蛋白巴豆酰转移酶。研究者基于质谱在Flag-GCDH蛋白复合物中检测到了CBP,并进一步验证了内源性核GCDH与CBP存在相互作用,表明与CBP结合的核GCDH对于Kcr调节至关重要。由于目前还没有特定的GCDH抑制剂,研究者基于计算机生物学框架-Lisa,发现MYC是唯一被预测的GCDH抑制剂候选者。后续,研究者通过实验验证发现赖氨酸限制与MYC抑制剂(MYCi)联合使用确实会抑制细胞Kcr水平以及GSC生长。
图4 赖氨酸分解代谢的重编程影响 I 型干扰素信号
4 细胞核GCDH与CBP结合并提高Kcr
约20%的GCDH定位于细胞核,而且除了ECHS1,其他赖氨酸降解酶也部分定位于细胞核,表明赖氨酸分解代谢可能对细胞核存在重要影响。因此研究者进一步探索了GCDH是否能直接连接组蛋白巴豆酰转移酶。研究者基于质谱在Flag-GCDH蛋白复合物中检测到了CBP,并进一步验证了内源性核GCDH与CBP存在相互作用,表明与CBP结合的核GCDH对于Kcr调节至关重要。由于目前还没有特定的GCDH抑制剂,研究者基于计算机生物学框架-Lisa,发现MYC是唯一被预测的GCDH抑制剂候选者。后续,研究者通过实验验证发现赖氨酸限制与MYC抑制剂(MYCi)联合使用确实会抑制细胞Kcr水平以及GSC生长。
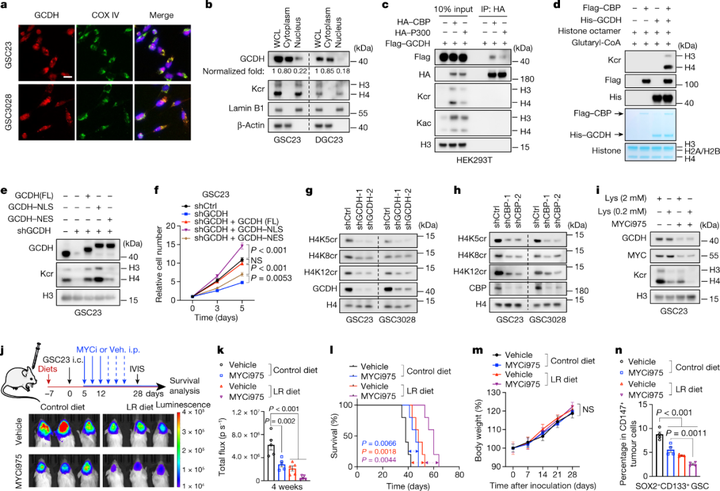
图5 GCDH与细胞核中的CBP相互作用以调节Kcr
5 限制赖氨酸摄入增强肿瘤免疫力之前的研究表明CBP也是乙酰辅酶A转移酶之一,因此研究者假设巴豆酰辅酶A与乙酰辅酶A竞争性地作为CBP底物。研究者发现在GSC中敲除GCDH后,组蛋白Kcr水平显著下降,但是H3K27ac水平显著升高和H3K9me3水平显著下降。此外,GCDH敲除所导致水平降低的Kcr结合位点定位于反转录转座子,ChIP-seq分析证实了转座因子中Kcr的衰减。表明赖氨酸分解代谢重编程导致的Kcr通过影响H3K27ac和H3K9me3来限制免疫原性转座因子。之前的研究表明逆转录转座子转录有助于免疫原性胞质dsRNA和DNA生成以及IFN活化,与之一致,研究者也发现组蛋白Kcr的局部丢失会促进细胞溶质dsRNA和DNA的生成,从而触发GSC中依赖于MDA5和cGAS的IFN信号传导。从脑胶质瘤患者的数据中,研究者还发现赖氨酸分解代谢抑制与CD4+T细胞、CD8+T细胞和自然杀伤细胞特征呈正相关,表明限制赖氨酸摄入会促进IFN作用以及CD8+T细胞浸润,最终抑制肿瘤生长。
图5 GCDH与细胞核中的CBP相互作用以调节Kcr
5 限制赖氨酸摄入增强肿瘤免疫力之前的研究表明CBP也是乙酰辅酶A转移酶之一,因此研究者假设巴豆酰辅酶A与乙酰辅酶A竞争性地作为CBP底物。研究者发现在GSC中敲除GCDH后,组蛋白Kcr水平显著下降,但是H3K27ac水平显著升高和H3K9me3水平显著下降。此外,GCDH敲除所导致水平降低的Kcr结合位点定位于反转录转座子,ChIP-seq分析证实了转座因子中Kcr的衰减。表明赖氨酸分解代谢重编程导致的Kcr通过影响H3K27ac和H3K9me3来限制免疫原性转座因子。之前的研究表明逆转录转座子转录有助于免疫原性胞质dsRNA和DNA生成以及IFN活化,与之一致,研究者也发现组蛋白Kcr的局部丢失会促进细胞溶质dsRNA和DNA的生成,从而触发GSC中依赖于MDA5和cGAS的IFN信号传导。从脑胶质瘤患者的数据中,研究者还发现赖氨酸分解代谢抑制与CD4+T细胞、CD8+T细胞和自然杀伤细胞特征呈正相关,表明限制赖氨酸摄入会促进IFN作用以及CD8+T细胞浸润,最终抑制肿瘤生长。
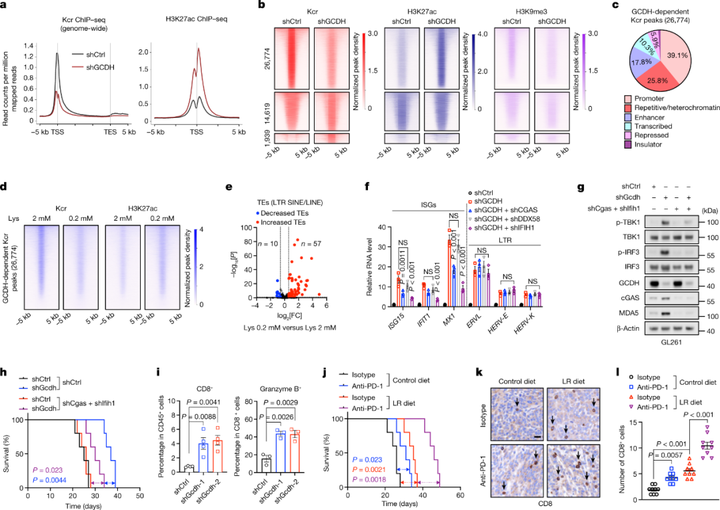
图6 抑制赖氨酸分解代谢促进抗肿瘤免疫
综上所述,胶质母细胞瘤干细胞通过重编程赖氨酸代谢产生的大量巴豆酰辅酶A,进而促进细胞整体巴豆酰化修饰。组蛋白H4巴豆酰化修饰通过影响H3K27ac和H3K9me3限制免疫原性转座因子,影响干扰素信号,抑制CD8+T细胞浸润,最终抑制肿瘤免疫反应促进肿瘤生长。最后,作者也提出通过赖氨酸饮食限制与MYC抑制剂或抗PD-1治疗的协同作用可以限制肿瘤生长。
参考文献
Yuan H, et al. 2023. Lysine catabolism reprograms tumour immunity through histone crotonylation. Nature.
本文由景杰学术团队报道,欢迎转发到朋友圈。如有转载、投稿等其他合作需求,请在文章下方留言,或添加微信ptm-market咨询。
图6 抑制赖氨酸分解代谢促进抗肿瘤免疫
综上所述,胶质母细胞瘤干细胞通过重编程赖氨酸代谢产生的大量巴豆酰辅酶A,进而促进细胞整体巴豆酰化修饰。组蛋白H4巴豆酰化修饰通过影响H3K27ac和H3K9me3限制免疫原性转座因子,影响干扰素信号,抑制CD8+T细胞浸润,最终抑制肿瘤免疫反应促进肿瘤生长。最后,作者也提出通过赖氨酸饮食限制与MYC抑制剂或抗PD-1治疗的协同作用可以限制肿瘤生长。
参考文献
Yuan H, et al. 2023. Lysine catabolism reprograms tumour immunity through histone crotonylation. Nature.
本文由景杰学术团队报道,欢迎转发到朋友圈。如有转载、投稿等其他合作需求,请在文章下方留言,或添加微信ptm-market咨询。
